题目内容
【题目】“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属Fe和金属钙Ca,并含有3.5%(质量分数)CaO.
(1)Ca的原子结构示意图为 . 其最高价氧化物对应水化物的碱性比Mg(OH)2(填“强”或“弱”).
(2)Ca与非金属性最强的元素A形成化合物D,写出D的电子式
(3)配平用“金属钙线”脱氧脱磷的方程式:
P+FeO+Cao ![]() Ca3(PO4)2+
Ca3(PO4)2+
(4)将“金属钙线”溶于稀盐酸后,再滴加双氧水发生的离子方程式是 .
(5)取3.2g“金属钙线”试样,与水充分反应生成448mL H2(标准状况),在所得溶液中通入适量CO2 , 最多能得到CaCO3g(取两位有效数字).
【答案】
(1)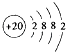 ;强
;强
(2)![]()
(3)2;5;3;1;5Fe
(4)2Fe2++H2O2+2H+═2Fe3++2H2O
(5)2.2
【解析】解:(1)Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为 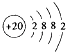 ,金属性Ca>Mg,则Ca(OH)2碱性比Mg(OH)2强,所以答案是
,金属性Ca>Mg,则Ca(OH)2碱性比Mg(OH)2强,所以答案是 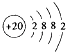 ;强;(2)元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF2 , 其电子式为
;强;(2)元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF2 , 其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)该方程式中元素的化合价变化为:P→Ca3(PO4)2 , 磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5FeO+3CaO
;(3)该方程式中元素的化合价变化为:P→Ca3(PO4)2 , 磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5FeO+3CaO ![]() Ca3(PO4)2+5Fe,
Ca3(PO4)2+5Fe,
所以答案是:2;5;3;1;5Fe;(4)金属钙线中含铁,Fe和稀盐酸反应生成氯化亚铁,亚铁离子不稳定,能被双氧水氧化生成铁离子,双氧水被还原生成水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2 H2O,所以答案是:2Fe2++H2O2+2H+═2Fe3++2 H2O;(5)448mlH2的物质的量为 ![]() =0.02mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.02mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为 ![]() =0.02mol,样品中CaO质量分数为3.5%,故氧化钙的质量为3.2g×3.5%=0.112g,故氧化钙的物质的量为
=0.02mol,样品中CaO质量分数为3.5%,故氧化钙的质量为3.2g×3.5%=0.112g,故氧化钙的物质的量为 ![]() =0.002mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸钙的质量为0.022mol×100g/mol=2.2g,
=0.002mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸钙的质量为0.022mol×100g/mol=2.2g,
所以答案是:2.2.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案