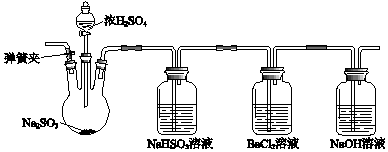
题目内容
【题目】硝酸铵广泛应用与工农生产中,其生产流程图如下,回答下列问题: 
(1)在上述工业制硝酸的生产中,B设备的名称是 , 在反应中的氧化产物是 .
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 . 在合成氨的设备(合成塔)中,设置热交换器的目的是;在合成硝酸的吸收塔中通入空气的目的是 .
(3)科学家以氨(NH3)为燃料开发新型的燃料电池.电池中填充可传导O2﹣离子的 MnO3固体电解质,电池总反应为:4NH3+3O2=2N2+6H2O.负极的电极反应式为 .
(4)某化肥厂用NH3制备NH4NO3 . 已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量约占总耗NH3质量(不考虑其它损耗)的%.(取两位有效数字)
(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是
【答案】
(1)氧化炉;NO
(2)铁触媒;利用余热,节约能源;可使NO全部转化成HNO3
(3)2NH3+3O2﹣﹣6e﹣=N2+3H2O
(4)53
(5)NH4+水解呈酸性,与碱混合促进其水解
【解析】解:(1)在上述工业制硝酸的生产中,B是氨气的催化氧化,氨气和氧气反应生成一氧化氮和水,B设备的名称为氧化炉,反应中氨气被氧化生成NO,在反应中的氧化产物是NO,所以答案是:氧化炉;NO;(2)此生产过程中,N2与H2合成NH3所用的催化剂是铁触媒,在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源,在合成硝酸的吸收塔中通入空气的目的是可使NO全部转化成HNO3 ,
所以答案是:铁触媒; 利用余热,节约能源; 可使NO全部转化成HNO3 ;(3)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+3O2﹣﹣6e﹣=N2+3H2O,
所以答案是:2NH3+3O2﹣﹣6e﹣=N2+3H2O;(4)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3 , 则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3 , 则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为: ![]() ×100%=53%,即制HNO3所用去的NH3的质量占总耗NH3质量的53%,
×100%=53%,即制HNO3所用去的NH3的质量占总耗NH3质量的53%,
所以答案是:53;(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是:NH4+水解呈酸性,与碱混合促进其水解,肥效损失,
所以答案是:NH4+水解呈酸性,与碱混合促进其水解.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案