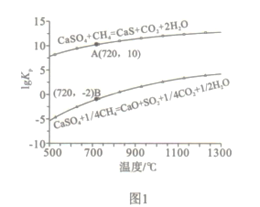
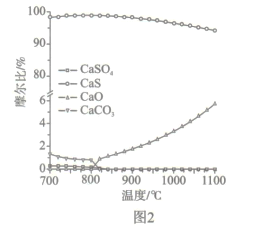
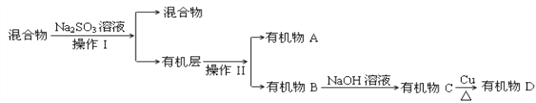
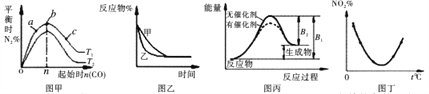
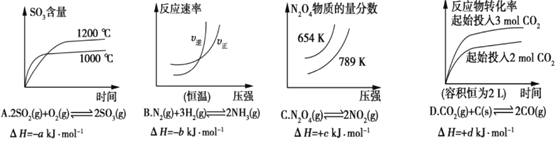
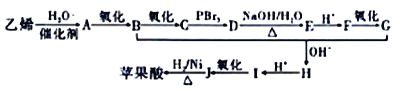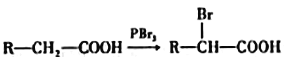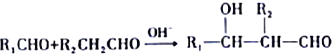题目内容
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀。
【答案】
(1)bc
(2)b
(3)94.7%
(4)10.5g或0.045mol或BaSO4
【解析】(1)a.可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的起始浓度以及转化率有关,a不符合题意;
b.可逆反应达到平衡状态时,各物质的百分含量不变,SO2百分含量保持不变,说明到达平衡状态,b符合题意;
c.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,c符合题意;
d.SO3的生成速率与SO2的消耗速率都表示正反应速率,反应始终二者都按1:1进行,不能说明到达平衡状态,d不符合题意;
e.混合气体的质量不变,容器的体积不变,所以密度始终不变,不能说明到达平衡状态,e不符合题意;
(2)a.向装置中再充入N2 , 反应物和生成物的浓度不变,平衡不移动,所以不能提高转化率,a不符合题意;
b.向装置中再充入O2 , 氧气浓度增大,平衡向正反应方向移动,提高了二氧化硫的转化率,b符合题意;
c.改变反应的催化剂只改变反应速率,不改变平衡,所以不能提高二氧化硫的转化率,c不符合题意;
d.向装置中再充入SO3 , 平衡向逆反应方向移动,降低了二氧化硫的转化率,d不符合题意;
(3)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,则参加反应的氧气的体积=0.7mol×22.4L/mol-5.6L=10.08L,根据二氧化硫、三氧化硫和氧气的关系式知,参加氧化还原反应的二氧化硫的体积=10.08L×2=20.16L,生成三氧化硫的体积=10.08L×2=20.16L,则未参加氧化还原反应的二氧化硫的体积=21.28L-20.16L=1.12L,原来二氧化硫的体积=20.16L+1.12L=21.28L,所以二氧化硫的转化率=20.16L/21.28L×100%=94.7%;
(4)依据(3)的计算可知混合气体中生成三氧化硫气体物质的量为0.9mol,在给定的条件下,溶液呈强酸性,BaSO3不会沉淀。因此BaSO4的质量=0.9mol×5%×233g/mol=10.5g。
故答案为:(1)bc;(2)b;(3)94.7%;(4)10.5g或0.045mol或BaSO4
(1)当可逆反应达到平衡状态时,则其正逆反应速率相等,反应体系中各物理量保持不变,据此分析选项;
(2)欲提高SO2的转化率,则应使平衡向正反应方向移动,结合平衡移动原理分析即可;
(3)平衡转化率=平衡时参与反应的量÷起始加入的量×100%,据此结合题干数据,从三段式入手进行计算;
(4)由平衡三段式的计算可知,反应后混合气体中含有SO2、SO3(0.9mol),且溶液显酸性,因此形成的沉淀应为BaSO4 , 结合反应的方程式可计算出沉淀的量;

 优百分课时互动系列答案
优百分课时互动系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
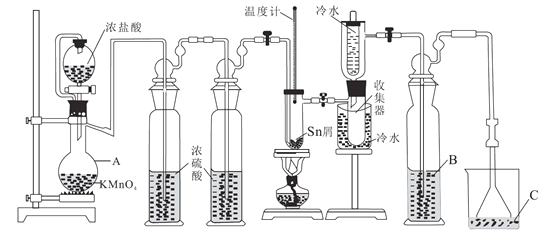
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
【题目】下表是元素周期表的一部分,根据表中给出的①—⑥六种元素,回答下列问题:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)画出元素④的原子结构示意图__________;
(2)元素①形成的最简单有机物的化学式是__________;
(3)表中所列元素中非金属性最强的元素是__________(填元素符号)
(4)元素⑤形成的最高价氧化物对应的水化物的化学式是__________;
(5)元素③和元素⑥形成的化合物的电子式是__________。
(6)表中所列元素中金属性最强的元素是__________(填元素符号)