题目内容
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
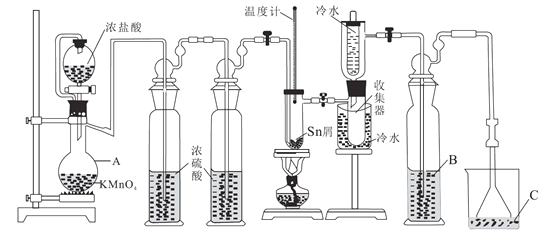
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
【答案】 蒸馏烧瓶 2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2O SnCl4 +(x+2)H2O=SnO2·xH2O↓+ 4 HCl↑ Sn+O2![]() SnO2 浓硫酸 氢氧化钠溶液 防止C溶液的水进入收集器 控制Sn与氯气的反应温度在232℃至650℃之间 过量氯气 (11.9cV/m)%
SnO2 浓硫酸 氢氧化钠溶液 防止C溶液的水进入收集器 控制Sn与氯气的反应温度在232℃至650℃之间 过量氯气 (11.9cV/m)%
【解析】(1)仪器A的名称是蒸馏烧瓶,其中浓盐酸和高锰酸钾反应生成氯化锰、氯气和水,发生反应的离子方程式是:2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2O;(2)点燃酒精灯前需排尽装置中的空气,否则SnCl4在空气中极易水解生成SnO2·хH2O,发生的副反应是SnCl4+(x+2)H2O=SnO2·xH2O↓+4HCl↑,防止Sn 在加热时被空气中氧气氧化,发生的副反应为:Sn+O2![]() SnO2;(3)SnCl4在湿空气中极易水解生成SnO2·xH2O,通过试剂B防止水蒸气进入收集器,故试剂B为浓硫酸;氯气有毒,试剂C吸收氯气的余气,故试剂C为氢氧化钠溶液;试剂B的作用是防止C溶液的水进入收集器;(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是控制Sn与氯气的反应温度在232℃至650℃之间,SnCl4蒸出而SnCl2残留;以及用过量氯气,使产物SnCl4的比例增大;(5)根据反应I2+Sn2+=2I-+Sn4+可知,SnCl4的含量为
SnO2;(3)SnCl4在湿空气中极易水解生成SnO2·xH2O,通过试剂B防止水蒸气进入收集器,故试剂B为浓硫酸;氯气有毒,试剂C吸收氯气的余气,故试剂C为氢氧化钠溶液;试剂B的作用是防止C溶液的水进入收集器;(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是控制Sn与氯气的反应温度在232℃至650℃之间,SnCl4蒸出而SnCl2残留;以及用过量氯气,使产物SnCl4的比例增大;(5)根据反应I2+Sn2+=2I-+Sn4+可知,SnCl4的含量为![]() ×100%=
×100%=![]() 。
。

 作业辅导系列答案
作业辅导系列答案【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
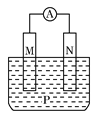
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
