题目内容
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
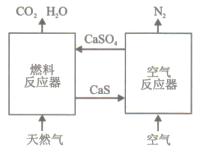
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
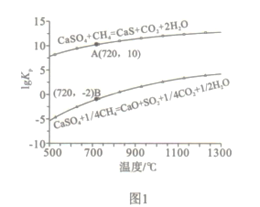
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
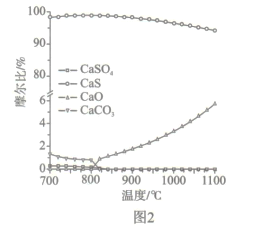
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
【答案】 ii > 1.0×10-18 B 温度过低,反应速率较慢 ;温度较高,副反应增多 放热 CaS、CaSO4 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kJ/mol
【解析】(1)①由图示可得,天然气和CaSO4进入燃料反应器,反应生成CaS、CO2和H2O,故燃料反应器中主反应为ii。②由图1可看出,温度越高lgKp越大,即升温Kp增大,故反应i和反应ii都是吸热反应,则a和b都大于0。设三个反应的平衡常数Kp分别为:Kpi、Kpii、Kpⅲ,根据盖斯定律,i-ii得ⅲ,所以Kpⅲ=![]() ;由图并结合热化学方程式可得720℃时反应i的lgKp为:-2×4=-8,反应ii的lgKp为10,所以Kpi=10-8,Kpii=1010,故Kpⅲ=
;由图并结合热化学方程式可得720℃时反应i的lgKp为:-2×4=-8,反应ii的lgKp为10,所以Kpi=10-8,Kpii=1010,故Kpⅲ=![]() =
=![]() =1.0×10-18。③A项,增加固体物质的投入量,不改变化学平衡,所以增加CaSO4固体的投入量不能提高反应ii中甲烷平衡转化率,故A错误;B项,将生成物分离出去能使化学平衡正向移动,所以将水蒸气冷凝能提高反应ii中甲烷平衡转化率,故B正确;C项,通过②的分析,该反应为吸热反应,降温能降低反应ii中甲烷平衡转化率,故C错误;D项,增大甲烷流量,增大了甲烷的浓度,平衡正向移动,但根据勒沙特列原理,甲烷平衡转化率会降低,故D错误。
=1.0×10-18。③A项,增加固体物质的投入量,不改变化学平衡,所以增加CaSO4固体的投入量不能提高反应ii中甲烷平衡转化率,故A错误;B项,将生成物分离出去能使化学平衡正向移动,所以将水蒸气冷凝能提高反应ii中甲烷平衡转化率,故B正确;C项,通过②的分析,该反应为吸热反应,降温能降低反应ii中甲烷平衡转化率,故C错误;D项,增大甲烷流量,增大了甲烷的浓度,平衡正向移动,但根据勒沙特列原理,甲烷平衡转化率会降低,故D错误。
(2)从反应速率角度考虑,温度过低,反应速率较慢,应在较高温度下反应,但由图2可得,温度越高,副反应增多,所以该燃料反应器最佳温度范围为850℃~900℃之间。
(3)①由方程式可看出该反应S<0,因为自发反应H-TS<0,所以H<0,故该反应为放热反应。②空气反应器中CaS和O2反应生成CaSO4,燃料反应器中,天然气和CaSO4反应生成CaS、CO2和H2O,所以在天然气燃烧过程中可循环利用的物质为:CaS和CaSO4。
(4)将反应CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol标号为iiii,分析空气反应器中发生的反应和燃料反应器中发生的反应,根据盖斯定律,ii+iiii或i-iii+iiii得该原理总反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kJ/mol。