题目内容
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
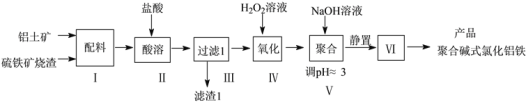
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
【答案】Fe2O3 + 6HCl = 2FeCl3 +3H2O SiO2 2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O 得到的是Fe(OH)3和Al(OH)3 过滤、洗涤和干燥 由步骤2 在2.855g样品中:160g·mol-1 × ![]() (Fe2O3) = 0.4000g,
(Fe2O3) = 0.4000g,![]() (Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al)/n(Fe)=
(Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al)/n(Fe)=![]()
【解析】
由流程图可知,铝土矿和硫铁矿烧渣酸溶时,Al2O3、Fe2O3和FeO与盐酸反应生成氯化铝、氯化铁和氯化亚铁,SiO2不与盐酸反应,过滤得含有氯化铝、氯化铁和氯化亚铁的滤液,滤渣1为没有反应的SiO2;酸性条件下,向滤液中加入双氧水溶液,氯化亚铁被双氧水氧化生成氯化铁;向反应后的溶液中加入氢氧化钠溶液,调节溶液pH为3,促进氯化铝和氯化铁的水解得到聚合碱式氯化铝铁,若溶液pH过大,可能会使氯化铝和氯化铁转化为Fe(OH)3和Al(OH)3沉淀,降低聚合碱式氯化铝铁的产率;静置后,过滤、洗涤和干燥得到聚合碱式氯化铝铁产品。
(1)步骤Ⅱ酸溶时,Fe2O3与盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3 + 6HCl = 2FeCl3 +3H2O;SiO2不与盐酸反应,过滤到的滤渣1为没有反应的SiO2,故答案为:Fe2O3 + 6HCl = 2FeCl3 +3H2O;SiO2;
(2)步骤Ⅳ为酸性条件下,氯化亚铁被双氧水氧化生成氯化铁,反应的离子方程式为2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O,故答案为:2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O;
(3)步骤V若将溶液pH调成6,溶液pH过大,可能会使氯化铝和氯化铁转化为Fe(OH)3和Al(OH)3沉淀,降低聚合碱式氯化铝铁的产率;静置后,过滤、洗涤和干燥得到聚合碱式氯化铝铁产品,故答案为:得到的是Fe(OH)3和Al(OH)3;过滤、洗涤和干燥;
(4)由步骤2 在2.855g样品中:160g·mol-1 × ![]() (Fe2O3) = 0.4000g,
(Fe2O3) = 0.4000g,![]() (Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al):n(Fe)=(2×0.025mol):(2×0.005mol)=5:1,故答案为:5:1。
(Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al):n(Fe)=(2×0.025mol):(2×0.005mol)=5:1,故答案为:5:1。

 阅读快车系列答案
阅读快车系列答案【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 | 氧化物 | 环境问题 | 主要来源 |
A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
B | SO2 | 温室效应 | 汽车尾气的排放 |
C | NO2 | 光化学烟雾 | 工厂废气的排放 |
D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
A. AB. BC. CD. D