题目内容
【题目】某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是

A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
【答案】D
【解析】
A、观察装置图可知,处理废水实质上是电解水。X极上产生H2,发生了还原反应,X极为阴极,Y极为阳极,Y极上发生氧化反应。X极的电极反应式为2H2O+2e-= =2OH- +H2↑,硫酸铵电离出的铵根离子向X极迁移,NH4++OH-=NH3H2O,离子交换膜1为阳离子交换膜,选项A正确;
B、a口进入稀氨水,氨水增强水的导电性,Y极产生O2,离子交换膜2为阴离子交换膜,SO42-经过离子交换膜2向Y极迁移,所以c口进入稀硫酸增强导电性,d口流出较浓硫酸,选项B正确;
C、Y极产生O2,在稀硫酸中水参与电极反应,选项C正确;
D、由电极反应式知,转移0.2 mol电子时可生成0.1 mol H2SO4,即生成9.8g H2SO4,选项D错误。
答案选D。

 名校课堂系列答案
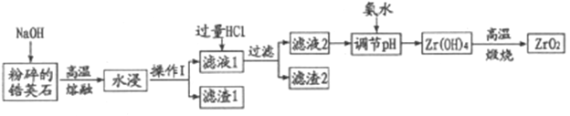
名校课堂系列答案【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。