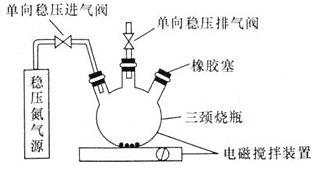
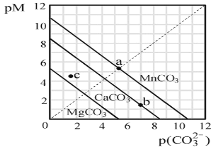
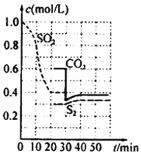
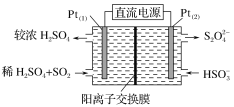
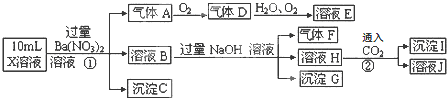
题目内容
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是__。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为__。
②部分化学键键能数据如下:

△H2=___kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__mol,N2的转化率为__。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__mol,N2的转化率为__。
(4)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1.68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是__,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要___。
【答案】高温下空气中的氮气与氧气反应产生的 C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1 +196 2.0×10-5 0.005% 该反应活化能高,反应速率慢 寻找耐高温的催化剂
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1 +196 2.0×10-5 0.005% 该反应活化能高,反应速率慢 寻找耐高温的催化剂
【解析】
此题借助汽车尾气转化过程,综合考查化学反应原理,考点涉及利用盖斯定律计算和书写热化学方程式,化学反应速率的影响因素,化学平衡及平衡常数的计算,考查学生的计算能力和分析能力。
(1)汽车燃料中不含氮元素,尾气中含NO,则N可能来源于空气,空气中的氮气与氧气在高温条件下发生反应得到NO;
(2)①已知I:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
II:H2O(1)=H2O(g) △H4=+44kJ·mol-1
根据盖斯定律,将I÷2-II ×9得,C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l), ΔH=△H1÷2-△H4×9=(-10244÷2-44×9) kJ·mol-1=-5518kJ·mol-1,即辛烷燃烧热的热化学方程式为C8H18(l)+
O2(g)=8CO2(g)+9H2O(l), ΔH=△H1÷2-△H4×9=(-10244÷2-44×9) kJ·mol-1=-5518kJ·mol-1,即辛烷燃烧热的热化学方程式为C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1;
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1;
②根据表格所给数据以及已知方程,将N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
将两热化学方程式相加,得到新的热化学方程式为2CO(g) +O2(g) = 2CO2(g) ΔH=△H2+△H3=(2×1076+494-4×799) kJ·mol-1=-550 kJ·mol-1,△H2=ΔH-△H3=[-550-(-746)] kJ·mol-1=+196 kJ·mol-1;
(3)设内燃机体积为V,则K=c2(NO)÷[c(N2)c(O2)]= n2(NO)÷[n(N2)n(O2)]= 2.0×10-6,代入数据算出n(NO)= 2.0×10-5 mol,则转化的N2的物质的量为1.0×10-5 mol,N2的转化率=1.0×10-5 mol÷(1.0×10-5 mol+0.2mol)×100%=0.005%;
(4)平衡常数很大,反应程度应该很大,实际汽车尾气中该反应的程度很小,可能是因为该反应活化能高,反应速率慢,要增大汽车尾气净化装置中单位时间内该反应的程度,即增加净化速率,需要降低活化能,需要寻找耐高温的催化剂。

【题目】今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:
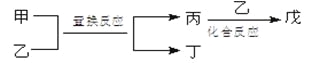
其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | HCOOH |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
A.AB.BC.CD.D