题目内容
【题目】如图所示为某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:
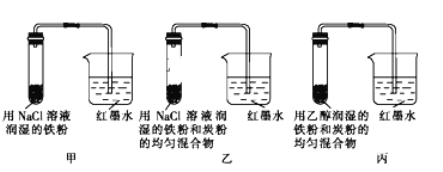
(1)起始时若甲、乙、丙三套装置的导管中液面高度相同,则过一段时间后导管中液面最高的是_____(填装置代号).
(2)通过甲、乙装置的对比实验说明,钢铁中碳的含量越_____(填“高”或“低”)越容易被腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_____.
(4)为防止铁的锈蚀,工业上普遍采用的方法是_____(写出一点即可).
【答案】乙 高 2H2O+O2+4e﹣═4OH﹣ 牺牲阳极的阴极保护法或者外加电流的阴极保护法
【解析】
(1)甲为铁粉在氯化钠溶液中的腐蚀,乙为铁粉与碳形成原电池的腐蚀,而丙的腐蚀没有电解质溶液,所以腐蚀的速率大小为:乙>甲>丙,故过一段时间后液面最高的是乙,故答案为:乙;
(2)甲中为铁粉,乙为铁粉与碳粉的混合物,甲的腐蚀速率小于乙的,通过甲、乙装置的对比说明钢铁中碳的含量越高,钢铁越易腐蚀,故答案为:高;
(3)乙装置中发生电化学腐蚀时,负极铁失去电子,正极氧气得到电子生成氢氧根离子,正极的电极反应式为:O2+4e﹣+2H2O═4OH﹣,故答案为:O2+4e﹣+2H2O═4OH﹣;
(4)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆等方法使金属与空气、水等物质隔离,以防止金属腐蚀,
故答案为:牺牲阳极的阴极保护法或者外加电流的阴极保护法。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目