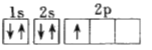
ћвƒњƒЏ»Ё
°Њћвƒњ°њќп÷ ‘ЏЋЃ÷–њ…ƒ№іж‘Џµзјл∆љЇв°ҐЋЃљв∆љЇвЇЌ≥Ѕµнµƒ»№љв∆љЇвµ»£ђЋь√«ґЉњ…њі„чїѓ—І∆љЇв°£«лЄщЊЁЋщ—Іµƒ÷™ ґїЎір£Ї
£®1£©0.1 mol°§L£≠1µƒNaHSO3»№“ЇµƒpH‘Љќ™4.0£ђ«лЈ÷ќцNaHSO3»№“Їѕ‘Ћб–‘µƒ‘≠“т____°£
£®2£© µ—й “≈д÷∆FeCl3»№“Ї ±£ђ–иљЂFeCl3»№љв‘Џљѕ≈®—ќЋб÷–£ђ»їЇуЉ”ЋЃѕ° Ќ£ђ’в—щ≤ў„чµƒƒњµƒ «____°£
£®3£©KCN»№“Ї÷–іж‘ЏCN°™+H2O![]() HCN+OH°™£ђЄ√Јі”¶‘Џ 25°ж ±µƒ∆љЇв≥£ эK=____°££®“—÷™£Ї25°ж ±£ђKa(HCN)=6.25°Ѕ10°™10£©
HCN+OH°™£ђЄ√Јі”¶‘Џ 25°ж ±µƒ∆љЇв≥£ эK=____°££®“—÷™£Ї25°ж ±£ђKa(HCN)=6.25°Ѕ10°™10£©
£®4£©“—÷™25°ж£ђKb(NH3°§H2O)£љ1.8°Ѕ10£≠5£ђH2CO3µƒKa1£љ4.2°Ѕ10£≠7°ҐKa2£љ4.7°Ѕ10£≠11°£‘тNH4HCO3»№“ЇµƒpH____£®ћо°∞£Њ°Ґ£Љїт=°±£©7°£
£®5£©ƒ≥µЎЇ£ЋЃ—щ∆ЈЊ≠Na2FeO4і¶јнЇу£ђЋщЇђјл„”Љ∞∆д≈®ґ»Љыѕ¬±нЋщ Њ£®H+ЇЌOH°™ќіЅ–≥ц£©
јл„” | SO42- | Mg2+ | Fe3+ | Na+ | Cl°™ |
≈®ґ»/mol°§L£≠1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
±нЄс÷–µƒa____0.16£®ћо°∞£Њ°Ґ£Љїт=°±£©°£
°Њір∞Є°њNaHSO3µƒµзјл≥ћґ»іу”Џ∆дЋЃљв≥ћґ»£ђє »№“Їѕ‘Ћб–‘ “÷÷∆FeCl3ЋЃљв 1.6°Ѕ10°™5 £Њ £Њ
°Њљвќц°њ
£®1£©NaHSO3 «»хЋбµƒЋб љ—ќ£ђHSO3-іж‘Џµзјл∆љЇвHSO3-![]() SO32-+H+£ђµзјл≥ Ћб–‘£їHSO3-іж‘ЏЋЃљв∆љЇвHSO3-+H2O
SO32-+H+£ђµзјл≥ Ћб–‘£їHSO3-іж‘ЏЋЃљв∆љЇвHSO3-+H2O![]() H2SO3+OH-£ђЋЃљв≥ Љо–‘£ђ0.1 mol°§L£≠1µƒNaHSO3»№“ЇµƒpH‘Љќ™4.0£ђЋµ√чNaHSO3µƒµзјл≥ћґ»іу”Џ∆дЋЃљв≥ћґ»£ђє »№“Їѕ‘Ћб–‘£ї
H2SO3+OH-£ђЋЃљв≥ Љо–‘£ђ0.1 mol°§L£≠1µƒNaHSO3»№“ЇµƒpH‘Љќ™4.0£ђЋµ√чNaHSO3µƒµзјл≥ћґ»іу”Џ∆дЋЃљв≥ћґ»£ђє »№“Їѕ‘Ћб–‘£ї
£®2£©FeCl3“„ЋЃљв£ђ—ќЋб“÷÷∆FeCl3ЋЃљв£ђ µ—й “≈д÷∆FeCl3»№“Ї ±£ђ–иљЂFeCl3»№љв‘Џљѕ≈®—ќЋб÷–£ђ»їЇуЉ”ЋЃѕ° Ќ£ї
£®3£©Ka(HCN)= 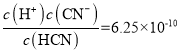 £їCN°™+H2O
£їCN°™+H2O![]() HCN+OH°™£ђ‘Џ 25°ж ±µƒ∆љЇв≥£ эK=
HCN+OH°™£ђ‘Џ 25°ж ±µƒ∆љЇв≥£ эK=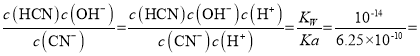 1.6°Ѕ10°™5£ї
1.6°Ѕ10°™5£ї
£®4£©“—÷™25°ж£ђKb(NH3°§H2O)£љ1.8°Ѕ10£≠5£ђ‘тNH4+µƒЋЃљв≥£ э «![]() £ђH2CO3µƒKa1£љ4.2°Ѕ10£≠7°ҐKa2£љ4.7°Ѕ10£≠11£ђ‘тHCO3-µƒЋЃљв≥£ э «
£ђH2CO3µƒKa1£љ4.2°Ѕ10£≠7°ҐKa2£љ4.7°Ѕ10£≠11£ђ‘тHCO3-µƒЋЃљв≥£ э «![]() £ђHCO3-µƒЋЃљв≥ћґ»іу”ЏNH4+µƒЋЃљв≥ћґ»£ђЋщ“‘»№“Ї≥ Љо–‘£ђpH£Њ7°£
£ђHCO3-µƒЋЃљв≥ћґ»іу”ЏNH4+µƒЋЃљв≥ћґ»£ђЋщ“‘»№“Ї≥ Љо–‘£ђpH£Њ7°£
£®5£©ЄщЊЁµзЇ… ЎЇг£ђ2c(SO42-)+ c(Cl-)+ c(OH-)= 2c(Mg2+)+ 3c(Fe3+)+ c(Na+)+ c(H+)£ђ2a+0.58+ c(OH-)=2°Ѕ0.05+3°Ѕ0.1+0.5+ c(H+)£ђ”…»№“ЇЇђ”–Fe3+њ…÷™£ђ»№“Ї≥ Ћб–‘£ђc(OH-)£Љc(H+)£ђЋщ“‘a£Њ0.16°£