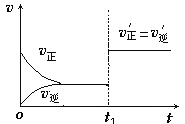
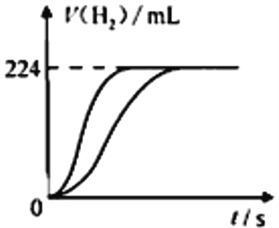
题目内容
【题目】下列实验操作正确的是( )
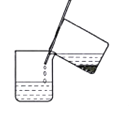
A.过滤时用玻璃棒搅拌漏斗里的液体
B.加热后的蒸发皿用坩埚钳夹取
C.用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中
D.从碘水中提取单质碘时,可用无水乙醇代替CCl4
【答案】B
【解析】解:A.过滤时,不能用玻璃棒搅拌,防止滤纸破损,故A错误;
B.取用加热后的蒸发皿,为防止烫伤,用坩埚钳夹取蒸发皿,故B正确;
C.温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故C错误;
D.乙醇易溶于水,不能用作萃取剂,一般用苯或四氯化碳等,故D错误.
故选B.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,其化学式都可表示为Z2X2Y![]() ,且C的摩尔质量比B大80g/
,且C的摩尔质量比B大80g/![]() ,请回答:
,请回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_________(填字母代号)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②向20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式______________________;
写出②中反应方程式___________________________。
(3)现由6种粒子![]() (C中含有的阴离子)、
(C中含有的阴离子)、![]() 完成一个离子方程式,已知
完成一个离子方程式,已知![]() 为还原剂,则得到
为还原剂,则得到![]() 需氧化剂的物质的量为_______
需氧化剂的物质的量为_______![]() .
.
(4)化合物D和E相互转化D![]() E,若有D和
E,若有D和![]() 的混合物13.04g,加热到完全反应后,气体产物通过浓
的混合物13.04g,加热到完全反应后,气体产物通过浓![]() 增重3.42g,剩余气体通过碱石灰增生2.20g,则
增重3.42g,剩余气体通过碱石灰增生2.20g,则![]() 的化学式为__________________________.
的化学式为__________________________.