题目内容
【题目】硼、氮、镁、铝、铜等在工业生产中都有广泛的用途。
(1)Cu+基态核外电子排布式为___________。
(2)金属Mg、Al中第一电离能较大的是_________。
(3)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为______(填化学式)。
(4)NH4NO3中N原子杂化轨道类型为_______。C、N、O三种元素的电负性由大到小的顺序为________,根据等电子原理,CO分子的结构式为________。
(5)1molCO(NH2)2·H2O2(过氧化尿素)中含有的σ键的数目为_________。
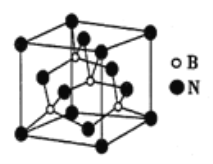
(6)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为_____,若立方氮化硼的密度为ρg/cm3,阿伏加德罗常数的值为NA,则距离最近的两个N原子之间的距离为_______cm。
【答案】 ls22s22p63s23p63dl0或[Ar] 3dl0 Mg CO和NH3 sp3和sp2 O>N>C C≡O 10NA(或6.02×l024) 4 ![]()
【解析】(1).铜原子为的核外电子排布为:ls22s22p63s23p63dl04s1,失去一个电子得到Cu+,其基态核外电子排布式为ls22s22p63s23p63dl0;
(2). Mg失去的是3s电子,Al失去的是3p电子,E3s小于E3p,p电子能量高而易失去,第一电离能Mg>Al;
(3). Cu与3个NH3和1个CO以配位键形成配离子;
(4). NO3-中N原子价层电子对个数是4、硝酸根离子中N原子价层电子对个数是3,所以N原子杂化方式为sp3杂化、sp2杂化;C、N、O三种元素为同周期,由左向右电负性增大,所以电负性O>N>C;CO与N2互为等电子体,所以CO的结构式为C≡O;
(5). CO(NH2)2H2O2中含有一个C=O,2个C-N,4个N-H,1个O-O,2个O-H,单键中含有一个σ键,双键中含有一个σ键,所以σ键的个数为10NA;
(6).面心的N原子,每个N原子连有4个B原子,所以出于晶胞顶点的N原子的配位数为4;
距离最近的N原子为面心与顶点的两个,则![]()

 阅读快车系列答案
阅读快车系列答案