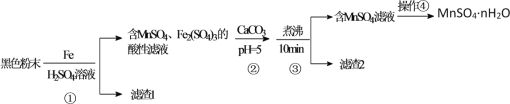题目内容
【题目】下列说法中正确的是
A. 25 ℃时0.1molL﹣1NH4Cl溶液的Kw大于100℃时0.01molL﹣1NaCl溶液的Kw
B. 常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108
C. 根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性
D. 室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
【答案】B
【解析】
A.水的电离吸热,升高温度促进水电离,则离子积常数增大,所以25℃时0.1molL-1NH4Cl溶液的Kw小于100℃时0.1molL-1NaCl溶液的Kw,故A错误;
B.酸抑制水的电离、含有弱离子的盐促进水的电离,则常温下pH=3的醋酸和硫酸铝溶液中由水电离出的c(H+)分别为:![]() mol/L=10-11 mol/L、10-3 mol/L,二者之比为1:108,故B正确;
mol/L=10-11 mol/L、10-3 mol/L,二者之比为1:108,故B正确;
C.温度未知,不能根据溶液的pH判断溶液酸碱性,pH=6.5的溶液可能呈酸性,可能呈碱性,也可能是中性,故C错误;
D.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合时氨水过量较多,溶液呈碱性,故D错误;
答案选B。

【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
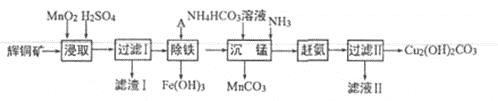
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。