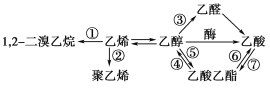
题目内容
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 1/351
【答案】C
【解析】
A.升高温度,H2S浓度增加,说明平衡逆向移动,因此正反应为放热反应,故A正确;
B.通入CO2瞬间,正反应速率最大,但随着反应进行,正反应速率逐渐减小,故B正确;
C. H2S(g) + CO2(g)COS(g)+H2O(g)
起始(mol) 0.40 0.10 0 0
转化(mol) x x x x
平衡(mol) 0.40-x 0.10-x x x
反应平衡后水的物质的量分数为0.02,则![]() =0.02,x=0.01,H2S的平衡转化率α=
=0.02,x=0.01,H2S的平衡转化率α=![]() ×100%=2.5%,故C错误;
×100%=2.5%,故C错误;
D.根据C的分析,平衡浓度:c(H2S)=![]() =0.156mol/L,c(CO2)=0.036mol/L,c(COS)=c(H2O)=0.004mol/L,平衡常数K=
=0.156mol/L,c(CO2)=0.036mol/L,c(COS)=c(H2O)=0.004mol/L,平衡常数K=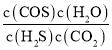 =
=![]() =
=![]() ,故D正确;
,故D正确;
答案选C。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
[ | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o |
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为_________。
(2)画出d元素原子的结构示意图_______________________________,其气态氢化物溶于水显_____________性。(填“酸”或“碱”)
(3)比较元素g和元素h形成的最高价氧化物的水化物的碱性强弱________>__________。
(4)表中j元素在元素周期表中的位置是______________________。
(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是___________(填写化合物的化学式,下同),具有两性的是_____________,