题目内容
【题目】用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:![]()
B.中子数为10的氧原子:![]() O
O
C.Na+的结构示意图:![]()
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
【答案】C
【解析】
A、水是由H和O构成的共价化合物,含有共价键不含离子键;
B、质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C、钠离子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子;
D、氢氧根离子为原子团不能拆。
A、水是由H和O构成的共价化合物,含有共价键不含离子键,其电子式为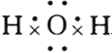 ,故A错误;
,故A错误;
B、中子数为10的氧原子的质量数为18,该原子可以表示为:818O,故B错误;
C、钠离子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图: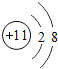 ,故C正确;
,故C正确;
D、氢氧化钠的电离方程式:NaOH═Na++OH﹣,故D错误;
答案选C。

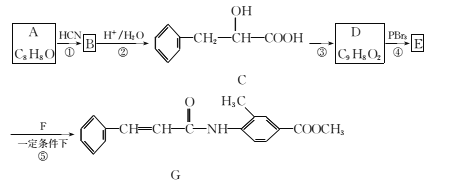
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
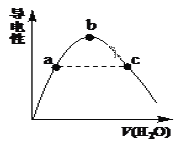
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。