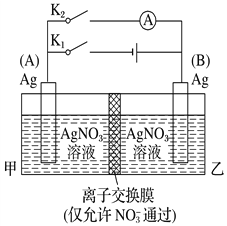
��Ŀ����
����Ŀ��һ�������������Ժ�CO2������Ӧ��Fe(s)+CO2(g) ![]() FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0
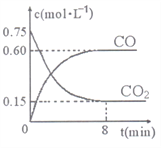
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ����ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)=______��
��2��д���÷�Ӧƽ�ⳣ����ʽ��K=__________�����д�ʩ����ʹ�÷�Ӧ��ƽ�ⳣ��K�������____������ţ���
A�������¶� B������ѹǿ C������CO D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2����CO2��ת���ʽ�______ �����������С���������䡱����
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
�ٸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ____________��
�ڸ�����ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
���������������____������ţ���
A���ŵ�ʱÿת��6mol���ӣ�������2mol K2FeO4����ԭ
B�����ʱ������ӦΪ��Zn(OH)2 +2e-=Zn+ 2OH-
C���ŵ�ʱ������ӦΪ��FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D�����ʱ����������Һ�ļ��Լ���
��5����֪��2CO(g)+O2(g)= 2CO2(g) ��H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g)����H=-483.6 kJ/mol
д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ��____________��
���𰸡� 0.075mol/(L��min) K=c(CO)/c(CO2) A ���� 2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O A CO (g) +H2O(g)=CO2 (g) +H2 (g) ��H=-41.2kJ/mol
����������1����ͼ��8min�ڣ�c(CO)=0.60mol/L����CO��ƽ����Ӧ����v(CO)=c(CO)��t(CO)=0.60mol/L��8min=0.075mol/(L��min)��
��2����һ���¶��£����淴Ӧ���ﵽƽ�⣬��������Ũ�ȵĻ�ѧ���������ݵij˻������Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻��ı�ֵ�Ǹ���������K��ʾ����������л�ѧƽ�ⳣ�����ٽ�ϸ÷�Ӧ��ѧ����ʽ��ƽ�ⳣ����ʽK=c(CO)/c(CO2)����ѧƽ�ⳣ��ֻ���¶�Ӱ�죬����֪�÷�ӦΪ���ȷ�Ӧ���������¶�ƽ�ⳣ��K����ֻ��Aѡ��������⡣
��3���÷�ӦΪ��Ӧǰ���������������ķ�Ӧ����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2���ﵽ��ƽ����ԭƽ���Ч����CO2��ת���ʲ��䡣
��4����ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ������������ԭ���غ�͵�ʧ�����غ��֪��һ�ֳ��������ﺬ����Ԫ�أ�ӦΪˮ�����ݵ���غ㣬���ӷ���ʽΪ2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O����A�������طŵ�ʱ��пԪ�صĻ��ϼ����ߣ���Ԫ�ػ��ϼ۽���(��+6��Ϊ+3)��K2FeO4�������Ϸ�����ԭ��Ӧ��ÿת��6mol���ӣ�����������2molK2FeO4����ԭ����A����B����ʱ����Zn(OH)2�����õ��ӵĻ�ԭ��Ӧ���������ҺΪ���ԣ��缫��ӦΪ��Zn(OH)2+2e-=Zn+2OH-����B��ȷ��C��ŵ�ʱ��������K2FeO4�õ��ӵĻ�ԭ��Ӧ���������ҺΪ���ԣ��缫��ӦΪ��FeO42-+3e-+4H2O=Fe(OH)3+5OH-����C��ȷ��D����ʱ��������Fe(OH)3ʧ���ӵ�������Ӧ����Fe(OH)3+5OH--3e-=FeO42-+4H2O���������������ӣ����Գ��ʱ����������Һ�ļ��Լ�������D��ȷ��
��5������֪��������Ӧ�ֱ�Ϊ����2CO(g)+O2(g)=2CO2(g) ��H=-566kJ/mol����2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol�����ݸ�˹���ɢ�-�ڵã�2CO(g)+2H2O(g)=2CO2(g)+2H2(g)��H=-82.4kJ/mol������CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41.2kJ/mol��