题目内容
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
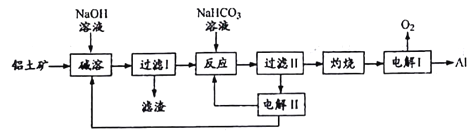
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________。
(2)向“过滤I”所得滤液中加入NaHCO3溶液,溶液的PH_____(填“增大”、“不变”或“减小”),NaHCO3中存在化学键有______
(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是________。
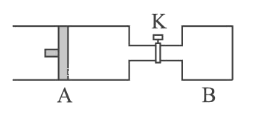
(4)“电解II”是电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为_______,阴极产生的物质A的化学式为_______。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________。
【答案】 Al2O3+2OH-==2AlO2-+H2O 减小 离子键和共价键 石墨电极被阳极上产生的O2氧化 4CO32-+2H2O-4e-=4HCO3- H2 NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气。
(1)“碱溶”时生成偏铝酸钠的离子方程式为:Al2O3+2OH-==2AlO2-+H2O;(2)向“过滤I”所得滤液中加入NaHCO3溶液,与NaAlO2反应生成氢氧化铝沉淀和碳酸钠,碱性为OH->AlO2->CO32-,可知溶液的pH减小,NaHCO3中存在化学键有:离子键和共价键;(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是石墨电极被阳极上产生的O2氧化。(4)由图可知,阳极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,则阴极产生的物质A的化学式为H2。(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜。