题目内容
2.五种短周期元素A、B、C、D、E的原子序数依次增大.A、B、C三种元素原子核外电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外层上的电子数是其电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3:4;E元素原子最外层电子数比次外层电子数少1.(1)D元素在周期表中的位置第二周期第ⅥA组族;CE3的结构式为
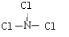 ;由A、B、D三种元素组成的18电子微粒的电子式为
;由A、B、D三种元素组成的18电子微粒的电子式为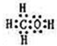
(2)B元素形成的同素异形体的晶体类型可能是①③
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)由A分别和B、C、D所形成的常见共价化合物中,热稳定性最好的是H2O(填物质的化学式),化合物CA3的空间构型为V型
(4)ED2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可用KED3和草酸在稀硫酸酸化的环境中反应制得气体ED2,试写出该反应的离子方程式并配平:2ClO3-+H2C2O4+2H+=2ClO2↑+2CO2↑+2H2O.
分析 五种短周期元素A、B、C、D、E的原子序数依次增大.B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为氢元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为氮元素,A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为氧元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,据此解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素;A、B、C三种元素原子核外电子层数之和是5,结合原子序数可知,A处于第一周期,则A为氢元素,C处于第二周期,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数,则C原子最外层电子数为1+4=5,故C为氮元素,A和C可以形成化合物NH3;B与D的原子序数之比为3:4,则D的原子序数为8,故D为氧元素;E元素原子最外层电子数比次外层电子数少1,原子序数大于O元素,处于第三周期,则E最外层电子数为7,为Cl元素,综上所述:A为H,B为C,C为N,D为O,E为Cl,
(1)O元素位于第二周期第ⅥA组族,NCl3的结构类似于氨气,故式NCl3的结构式为: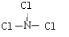 ,C、H、O三种元素组成的18电子微粒为甲醇,电子式为:
,C、H、O三种元素组成的18电子微粒为甲醇,电子式为: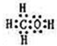 ,
,
故答案为:第二周期第ⅥA组族;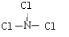 ;
;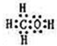 ;
;
(2)C元素形成的同素异形体为金刚石或C60,金刚石为原子晶体,C60为分子晶体晶体,
故答案为:①③;
(3)由H分别和C、N、O所形成的常见共价化合物为甲烷、氨气和水,由于在C、N、O中氧的非金属性最强,所以水的热稳定性最好,水分子中氧原子上有两对孤电子对,所以水的空间构型为V型,
故答案为:H2O;V型;
(4)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可用KClO3和草酸在稀硫酸酸化的环境中反应制得气体ClO2,根据元素守恒和电荷守恒可知,该反应的离子反应方程式为:2ClO3-+H2C2O4+2H+=2ClO2↑+2CO2↑+2H2O,
故答案为:2ClO3-+H2C2O4+2H+=2ClO2↑+2CO2↑+2H2O.
点评 本题主要考查的是元素的推断依据元素化合物知识,正确书写离子反应方程式等是关键,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 铝和盐酸反应 | B. | 焦炭和二氧化碳共热 | ||
| C. | 石灰石的分解 | D. | 氢气还原氧化铜 |

| A. | 及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动 | |
| B. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| C. | 试管b中导气管下端不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| D. | 反应结束后用分液的方法分离试管b中的混合液 |
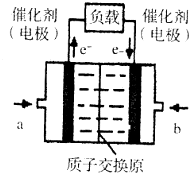 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
| A. | 右电极为电池正极,b处通入的物质是氧气 | |
| B. | 左电极为电池负极,a处通入的物质是氧气 | |
| C. | H2在负极发生氧化反应 | |
| D. | 供电时的总反应为:2H2+O2=2H2O |
| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
| A. | H2O | B. | N2 | C. | H2O2 | D. | C2H4 |
| A. | 一个N≡N断裂的同时,有3个H-H键断裂 | |
| B. | 保持其它条件不变时,体系压强不再改变 | |
| C. | 恒温恒容时,密度保持不变 | |
| D. | 正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min |
 图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O
图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O (烃基可用R1、R2、R3表示).
(烃基可用R1、R2、R3表示). .
.