题目内容
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答: 。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的
FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:
②产品中Mg(ClO3)2·6H2O的质量分数为 。
(1)漏斗、玻璃棒、烧杯 BaSO4和Fe(OH)3
(2)静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全
(3)蒸发结晶 趁热过滤 冷却结晶
(4)①ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O(2分)
②78.3%(3分)
解析试题分析: (1)加入高锰酸钾将Fe2+氧化为Fe3+,加入氯化钡形成硫酸钡沉淀,加入氧化镁调节pH=4将Fe3+形成氢氧化铁沉淀,过滤所得滤渣为硫酸钡和氢氧化铁,过滤需使用的玻璃仪器有漏斗、烧杯和玻璃棒。(2)静置,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,说明SO42-沉淀完全。(3)相同条件下,四种物质中氯化钠溶解度最小,所以加入氯酸钠溶液后,蒸发浓缩,氯化钠析出,趁热过滤,滤液为氯酸镁溶液,将滤液降温结晶得到氯酸镁晶体。(4)ClO3-与Fe2+生成Cl-和Fe3+,离子方程式为ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O。锥形瓶中过量的Fe2+物质的量为0.009mol,与ClO3-反应的Fe2+为0.011mol,所以Mg(ClO3)2·6H2O物质的量为0.011/12mol,Mg(ClO3)2·6H2O质量分数为0.783。
考点: 化学实验 离子方程式的书写 化学计算

某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰 ②将海带灰浸泡得其悬浊液 ③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘 ⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |
(3)用有机溶剂将碘从水中提取出来需用到下列哪套装置

(4)若用四氯化碳作溶剂进行提取,则分层后下层物质为
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___?___ |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量 ? | ? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④ 离子 |

称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因_________。
碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。
(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在; ②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入______ | 无现象 | 证明不是以IO3ˉ形式存在 |
| ③ | 往试管II中加入_______ | _______________ | 证明以 形式存在 形式存在 |
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 | |
| 步骤2:_____________________________ __________________________________ | ________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ | ___________________________________ _______,结合步骤2中的结论,假设2成立。 |
下图是产生和收集气体的实验装置,该装置适合于
| A.用H2O2溶液和MnO2反应制取O2 |
| B.用浓盐酸和MnO2反应制取C12 |
| C.用稀硫酸与石灰石反应制取CO2 |
| D.用NH4C1和Ca(OH)2反应制取NH3 |
下列气体组(括号内为杂质)可用如图装置提纯的是( )
| A.H2S(HCl) | B.NO2(CO2) | C.C2H6(C2H4) | D.CO2(H2S) |






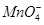 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。