��Ŀ����
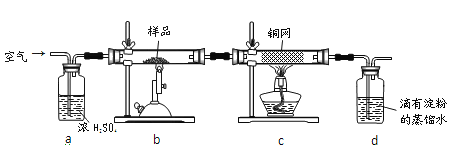
����Ŀ��������������ɫ����ˮ����ζ��Һ�壬�е�Ϊ 77.2 ����ʵ����ij����ȡ���������ñ����ᡢ�Ҵ���Ũ���ᡢ����̼������Һ�Լ��������Ҵ���ϵ��Ȼ�����Һ����Ҫװ������ͼ��ʾ��
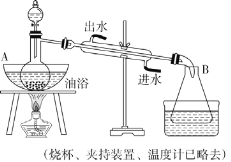
ʵ�鲽�裺
������ A �е�������ƿ��ע�������Ҵ���Ũ�����ҡ�ȣ��ٽ�ʣ�µ������Ҵ��ͱ�����ע���Һ©������á�
��������ԡ���¡�
������Һ©���е�Һ�建������������ƿ�
���ڼ������ʣ�ʹ��������������������ʴ�����ȣ�ֱ��������ɡ�
��������ԡ�¶�һ��ʱ�䣬��������Һ�������ֹͣ���ȡ�
��ȡ�� B �е���ƿ����һ�������� Na2CO3 ��Һ����������εؼӵ����Һ��ӱ����������ݲ���Ϊֹ��
��������Һ�������÷�Һ©����Һ����ȥˮ�㡣
�������� CaCl2 ��Һ(����)�����Һ©���У���һ��ʱ����ã��ų�ˮ��(��Һ)��
����Һ©����õ����dz����ᴿ������������Ʒ��
(1)ʵ����Ũ�������Ҫ������_____��
(2)�ñ��� Na2CO3 ��Һϴ�Ӵ�����Ŀ����_____���ñ��� CaCl2��Һϴ�Ӵ�����Ŀ����_____��
(3)�ڲ��������õĴ����ﻹ���е�������_____��
(4)д����ʵ����ȡ���������Ļ�ѧ����ʽ��_____��
(5)���� 46g �Ҵ��� 30g ���ᷴӦ�����ʵ�ʲ��������۲��ʵ� 65%���Լ���ɵõ�����������������Ϊ______��
���𰸡���������ˮ�� �к����ᡢ�ܽ��Ҵ������������������ܽ�� ��ȥ�Ҵ� ˮ CH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O 28.6g
CH3COOCH2CH3+H2O 28.6g
��������
�������Ҵ���Ũ���������������·���������Ӧ��������������ͬʱ����������������������ȴ���ñ���̼������Һ��Һ���գ������ѧ֪ʶ���н��⡣
(1) �������Ҵ�����������Ӧ����Ũ�������������ӿ췴Ӧ���ʣ��÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ���������������������ƶ�������Ũ���������Ϊ��������ˮ����
(2) �Ʊ���������ʱ���ñ���̼������Һ��Ŀ�����кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ����������ñ��� Na2CO3 ��Һϴ�Ӵ�����Ŀ�����к����ᡢ�ܽ��Ҵ������������������ܽ�ȣ��Ȼ�����Һ�������Ҵ���ϳ���ˮ�����˱���CaCl2��Һ�����������������п��ܲ������Ҵ������ñ��� CaCl2��Һϴ�Ӵ�����Ŀ���dz�ȥ�Ҵ���
(3) ����̼������Һ������������Ҵ�������CaCl2��Һ�����������������п��ܲ������Ҵ�������������Ĵ����лẬ������ˮ��
(4) �������Ҵ�����������Ӧ����ȥ�ǻ���ȥ�⣬��ȡ���������Ļ�ѧ����ʽΪCH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
(5) ���ݷ���ʽCH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O����֪60g ������46g �Ҵ�ǡ����ɷ�Ӧ����46g �Ҵ��� 30g ���ᷴӦʱ���Ҵ�������
CH3COOCH2CH3+H2O����֪60g ������46g �Ҵ�ǡ����ɷ�Ӧ����46g �Ҵ��� 30g ���ᷴӦʱ���Ҵ�������
CH3COOH + C2H5OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
![]()
���m������������=28.6g��

����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��ϡ��������⣩������˵����ȷ����______��
a��ԭ�Ӱ뾶�����Ӱ뾶����С
b�������Լ������ǽ�������ǿ
c�����ʵ��۵㽵��
d���������Ӧ��ˮ������Լ�����������ǿ
ԭ�������������������������ͬ��Ԫ������Ϊ_____�������������ļ���������____��
(2)��֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ����_____������ʱ�����Al2O3�������AlCl3��ԭ����_____��
(3)����裨�۵�1410���������õİ뵼����ϡ��ɴֹ��ƴ���������£�
Si���֣�![]() SiCl4
SiCl4![]() SiCl4������
SiCl4������![]() Si������
Si������
д��SiCl4�ĵ���ʽ��_____��
(4)�������岻����Ũ����������P2O5�������_____��
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____��