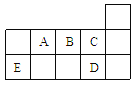
题目内容
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
【答案】OH-+Al(OH)3=AlO2-+2H2O Na+[![]() ]2-Na+ SO2+Cl2+2H2O=2HCl+H2SO4 否 HCl>H2S S2->Cl->Na+>Al3+
]2-Na+ SO2+Cl2+2H2O=2HCl+H2SO4 否 HCl>H2S S2->Cl->Na+>Al3+
【解析】
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,W、X各自的最高价氧化物对应的水化物可以两两反应,则X为铝元素,W为钠元素,W、X、Y、Z均为第三周期元素,W与Y可形成化合物W2Y,则Y为硫元素,Z的原子序数比Y大,所以Z为氯元素,据此答题。
(1)W、X各自的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O。
(2)W与Y可形成化合物Na2S,Na2S由钠离子和硫离子组成,电子式为Na+[![]() ]2-Na+,故答案为:Na+[
]2-Na+,故答案为:Na+[![]() ]2-Na+。
]2-Na+。
(3)二氧化硫通入氯水中,反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4,Y的最高价氧化物为SO3,SO3中,S原子的最外层电子为:6+6=12,O原子的最外层电子为:6+|-2|=8,不都满足8电子稳定结构,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;否。
(4)因为氯的非金属性强于硫,所以氯化氢的稳定性强于硫化氢,故答案为:HCl>H2S。
(5)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+。