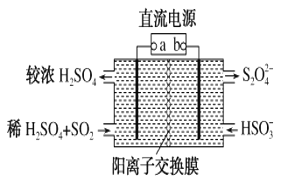
题目内容
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
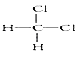
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
【答案】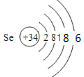 Na+[:H]- NH4 N3 NH4NO3
Na+[:H]- NH4 N3 NH4NO3 ![]() N2O↑+2H2O 0.8NA或2.408×1023 向硫化钠或硫化氢水溶液中通氯气,出现淡黄色浑浊
N2O↑+2H2O 0.8NA或2.408×1023 向硫化钠或硫化氢水溶液中通氯气,出现淡黄色浑浊
【解析】
在短周期中A元素原子半径最小,则A为氢元素;A与F可形成离子化物FA,则F为ⅠA元素,结合A、B、C、D、E、F是短周期主族元素,且原子半径依次增大,可知F为Na元素;C的简单氢化物常用作制冷剂,此制冷剂应为NH3,则C为N元素;D、E、F均为第三周期元素,B、E同主族,结合同周期主族元素的核电荷数越大,原子半径越小,可知:D为Cl元素、E为S元素、B为O元素。
由分析知:A为H元素、B为O元素、C为N 元素、D为Cl元素、E为S元素、F为Na元素;
(1)E为S元素,G是S下一周期同主族元素,则G为Se元素,Se的原子结构示意图为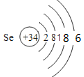 ;
;
(2)H与Na形成离子化物FA的电子式为Na+[:H]-;
(3)化学家发现一种原子组成比为H4N4的离子化合物,此化合物中含有NH4+,则该化合物的化学式为NH4N3;
(4)N2H4O3是一种常见的炸药,化学式应为NH4NO3,其在常温下撞击时会生成一种气体(N2O)和H2O,该反应的化学方程式为NH4NO3 ![]() N2O↑+2H2O;16gNH4NO3的物质的量为,
N2O↑+2H2O;16gNH4NO3的物质的量为,![]() =0.2mol,N元素从+5价降为+1价,则反应中转移的电子数目为0.8NA;
=0.2mol,N元素从+5价降为+1价,则反应中转移的电子数目为0.8NA;
(5)利用氧化剂的氧化性大于氧化产物,则向硫化钠或硫化氢水溶液中通氯气,出现淡黄色浑浊,发生反应的方程式为Na2S+Cl2=S↓+2NaCl,此反应中Cl2的氧化性大于S,即Cl的非金属性比S强。

【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
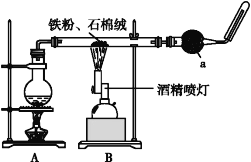
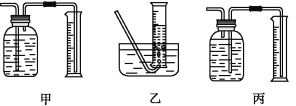
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |