题目内容
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
【答案】> > ![]() CH3COOH>H2CO3>HClO > 4 c(A-)>c(Na+)>c(H+)>c(OH-)
CH3COOH>H2CO3>HClO > 4 c(A-)>c(Na+)>c(H+)>c(OH-) ![]()
【解析】
(1)①ClO-水解,根据电荷守恒及NaClO溶液碱性强,因此NaClO溶液c(OH-)大,c(H+)小得出结论;
②根据NaHCO3溶液的pH计算HCO3-的水解常数,在相同温度下,根据同浓度对应盐的碱性大小得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强。
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,如果pH =a的HCl中加入等体积NaOH时后呈中性,则NaOH的pH = 14a,但醋酸是弱酸,物质的量比盐酸多,则消耗的氢氧化钠也多。
(3)①常温下,0.1molL1一元酸HA溶液中![]() =1×106,结合水的离子积计算c(H+) ;
=1×106,结合水的离子积计算c(H+) ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,混合后溶液显酸性,溶质为NaA和HA,HA的电离程度大于NaA的水解程度,溶液显酸性。
⑷根据混合后溶液显中性,溶质为硫酸铵和氨水的混合物及电荷守恒、物料守恒计算NH3·H2O的电离平衡常数。
⑴①ClO-水解,因此等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl和ClO离子个数:Cl- > ClO-;根据电荷守恒c(Na+)+ c(H+) = c(ClO-) + c(OH-),c(Na+) c(ClO-) = c(OH-) c(H+),c(K+) +c(H+)= c(CH3COO-)+c(OH-),c(K+)c(CH3COO-)= c(OH-) c(H+),NaClO碱性强,因此NaClO溶液c(OH-)大,c(H+)小,两者差值大,因此浓度相等的NaClO和CH3COOK溶液中:[c(Na+)c(ClO-)] >[c(K+)c(CH3COO-)];故答案为:>;>。
②0.1mol/LNaHCO3溶液的pH为8.3,即c(H+)=10-8.3,根据HCO3-+H2OH2CO3+OH-,HCO3-的水解常数为![]() ;在相同温度下,0.1mol/LCH3COOK、NaClO、NaHCO3溶液的pH依次为8.1、9.7、8.3,根据“越弱越水解”得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强,因此同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为CH3COOH>H2CO3>HClO;故答案为:
;在相同温度下,0.1mol/LCH3COOK、NaClO、NaHCO3溶液的pH依次为8.1、9.7、8.3,根据“越弱越水解”得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强,因此同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为CH3COOH>H2CO3>HClO;故答案为:![]() ;CH3COOH>H2CO3>HClO。
;CH3COOH>H2CO3>HClO。
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,如果pH =a的HCl加入等体积NaOH时后呈中性,则NaOH的pH = 14a,但醋酸是弱酸,物质的量比盐酸多,则消耗的氢氧化钠也多,而体积相同,则需要的碱性更强,因此NaOH的pH> 14a;故答案为:>。
(3)①常温下,0.1molL1一元酸HA溶液中![]() =1×106,c(H+)c(OH-)=1×10-14,解得c(H+) =1×104 molL1,则0.1 molL1 HA溶液的pH=4;故答案为:4。
=1×106,c(H+)c(OH-)=1×10-14,解得c(H+) =1×104 molL1,则0.1 molL1 HA溶液的pH=4;故答案为:4。
②pH=3span>的HA与pH=11的NaOH溶液等体积混合后,充分反应后得到溶液的溶质为NaA和HA,HA的电离大于NaA水解,溶液显酸性,因此溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-);故答案为:c(A-)>c(Na+)>c(H+)>c(OH-)。
(4)常温下,a molL1氨水与等体积0.1 molL1H2SO4溶液混合后溶液显中性,c(H+)=c(OH-)=1×10-7mol/L,溶质为硫酸铵和氨水的混合物,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则c(NH4+)=0.1mol/L,根据物料守恒c(NH4+)+c(NH3·H2O)=![]() mol/L,c(NH3·H2O)=(
mol/L,c(NH3·H2O)=(![]() -0.1)mol/L,则NH3·H2O的电离平衡常数
-0.1)mol/L,则NH3·H2O的电离平衡常数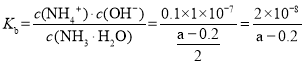 ;故答案为:
;故答案为:![]() 。
。