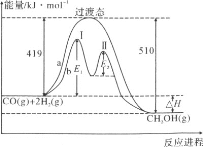
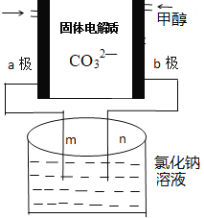
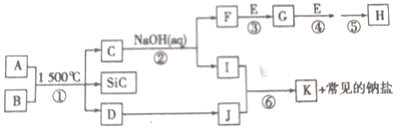
题目内容
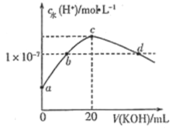
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
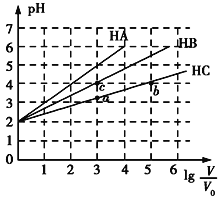
A.常温下:Ka(HB)>Ka(HC)
B.HC的电离度:a点<b点
C.当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D.当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
【答案】D
【解析】
根据图知,pH=2的HA、HB、HC溶液分别稀释100倍,HA的pH变成4,说明HA是强酸,HB、HC的pH增大小于2,则HB、HC为弱酸,且HB的pH增大幅度大于HC,说明HB的酸性>HC,因此酸性HA>HB>HC。
A.分析可知,酸性HB>HC,则Ka(HB)>Ka(HC),与题意不符,A错误;
B.溶液的浓度越小,弱酸的电离程度越大,因此HC的电离度:a点<b点,与题意不符,B错误;
C.当lg=4,即稀释10000倍时,三种溶液同时升高温度,常见弱电解质的电离程度增大,而HA为强酸,电离程度不变,因此![]() 减小,与题意不符,C错误;
减小,与题意不符,C错误;
D.当lg=5时,HA电离出的c(H+)=107 mol/L,此时,不能忽略水的电离,溶液中c(H+)略大于107 mol/L,pH略小于7,仍显酸性,符合题意,D正确。
答案为D。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
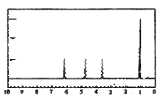
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |