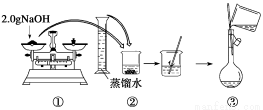
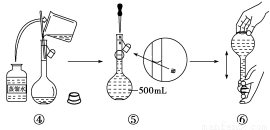
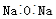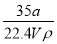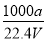题目内容
已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
ΔH=-2 600 kJ·mol-1
②2C6H6(g)+15O2(g)=12CO2(g)+6H2O(l)
ΔH=-6 590 kJ·mol-1
下列说法正确的是( )
A.2 mol C2H2(g)完全燃烧生成气态水时放热大于2 600 kJ
B.2 mol C6H6(l)完全燃烧生成液态水时放热大于6 590 kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
D
【解析】A项,生成气态水放出的热量小于生成液态水放出的热量;B项,液态苯燃烧放出热量少;C项,1 g乙炔放出的热量: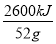 =50 kJ·g-1
=50 kJ·g-1
1 g苯放出的热量: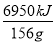 =44.55 kJ·g-1
=44.55 kJ·g-1
质量相同时,C2H2放热更多;D项,①×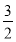 -②÷2得
-②÷2得
3C2H2(g)=C6H6(g) ΔH=-605 kJ·mol-1。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目