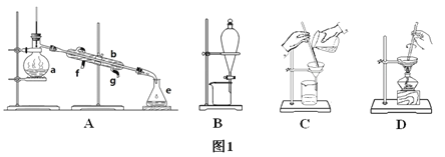
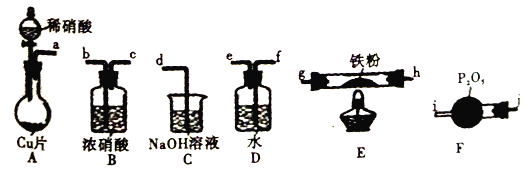
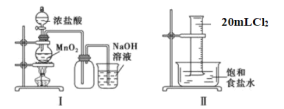
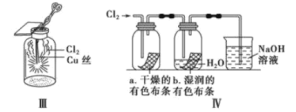
题目内容
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
【答案】 第三周期第ⅦA族 H3PO4>H2SiO3
第三周期第ⅦA族 H3PO4>H2SiO3 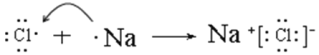 OH+Al(OH)3=AlO2+2H2O 1
OH+Al(OH)3=AlO2+2H2O 1
【解析】
A、B、C、D、E为原子序数依次增大的短周期元素,C元素的最外层电子数比次外层电子数少4,则C元素原子有3个电子层,最外层电子数为4,则C为Si元素;D元素原子序数大于硅元素,处于第三周期,D元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则D为磷元素;A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强酸、强碱的反应,则A为Na、B为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则E为Cl元素,据此解答。
(1)由以上分析可知:D为P,原子结构示意图是 ,E是氯元素,在元素周期表中的位置为第三周期第ⅦA族;
,E是氯元素,在元素周期表中的位置为第三周期第ⅦA族;
(2)C的最高价氧化物的水化物是H2SiO3,D的最高价氧化物的水化物是H3PO4,同一周期从左到右非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,故酸性是H3PO4>H2SiO3;
(3)A与E两元素可形成离子化合物NaCl,用电子式表示其化合物的形成过程为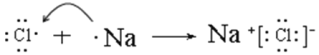 ;
;
(4)A、B两元素最高价氧化物的水化物分别为NaOH和Al(OH)3,相互反应的离子方程式为OH+Al(OH)3=AlO2+2H2O;
(5)E单质是氯气,与水反应生成氯化氢和次氯酸,氯元素的化合价既升高又降低,1mol氯气与水反应转移的电子数是1mol。

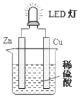
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。