题目内容
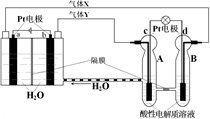
(10分)如图 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,正极的电极反应式为____________;负极的电极反应式为____________。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池。若不能,请说明理由;若能,请说明在两电极上所发生的现象:________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液。则氢气应通入________(填“a”或“b”)极,正极上的电极反应式为___________。
 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,正极的电极反应式为____________;负极的电极反应式为____________。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池。若不能,请说明理由;若能,请说明在两电极上所发生的现象:________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液。则氢气应通入________(填“a”或“b”)极,正极上的电极反应式为___________。
(1) 2H++2e-=H2↑ (2分) Mg-2e-=Mg2+(2分)
(2)能(1分); 负极铝片溶解,正极镁片上有气泡产生(2分)
(3) b (1分) O2 + 2H2O + 4eˉ="=" 4OHˉ(2分)
(2)能(1分); 负极铝片溶解,正极镁片上有气泡产生(2分)
(3) b (1分) O2 + 2H2O + 4eˉ="=" 4OHˉ(2分)
试题分析:(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,由于镁的金属性强于铝,因此镁是负极失去电子,铝是正极,溶液中的氢离子放电,则正极的电极反应式为2H++2e-=H2↑;极的电极反应式为Mg-2e-=Mg2+。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,由于能和氢氧化钠溶液反应的是金属铝,所以此时铝是负极失去电子,镁是正极,溶液中的氢离子放电产生氢气,所以在两电极上所发生的现象为负极铝片溶解,正极镁片上有气泡产生。
(3)原电池中负极失去电子,正极得到电子,则氢气应通入b极,正极上氧气得到电子,其电极反应式为O2 + 2H2O + 4eˉ="=" 4OHˉ。

练习册系列答案
相关题目