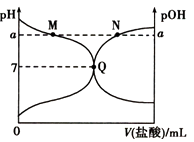
题目内容
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
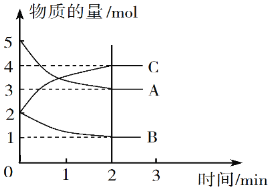
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
【答案】 放热 催化剂与反应物的接触面积 2A+B![]() 2C 0.1 mol/(L·min) BC 放出90.8
2C 0.1 mol/(L·min) BC 放出90.8
【解析】(1)根据触摸试管很烫分析;
(2)根据反应完成所需的时间判断;
Ⅱ.(3)根据图像分析;
(4)根据B的浓度变化量分析;
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此解答。
Ⅲ.(6)根据ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量计算。
I.(1)触摸试管时很烫,说明该反应是放热反应。
(2)实验结果表明有粉末状的二氧化锰的反应完成所需的时间少,催化效果更好,这说明催化剂的催化效果与催化剂的接触面积有关。
Ⅱ.(3)反应进行到2min时各种物质的物质的量不再发生变化,反应达到平衡状态,此时消耗A是5mol-3mol=2mol,消耗B是2mol-1mol=1mol,生成C是4mol-2mol=2mol,因此根据变化量之比是相应的化学计量数之比可知该反应的的化学方程式为2A+B![]() 2C。(4)反应开始至2分钟时,消耗B的浓度是1mol÷5L=0.2mol/L,所以用B表示的平均反应速率为0.2mol/L÷2min=0.1mol/(L·min)。
2C。(4)反应开始至2分钟时,消耗B的浓度是1mol÷5L=0.2mol/L,所以用B表示的平均反应速率为0.2mol/L÷2min=0.1mol/(L·min)。
(5)A.v(A)=2v(B)没有指明反应的方向,不一定处于平衡状态,A错误;B.正反应体积减小,则容器内压强保持不变说明反应处于平衡状态,B正确;C.v逆(A)=v正(C)表示正逆反应速率相等,反应处于平衡状态,C正确;D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应处于平衡状态,D错误,答案选BC。
Ⅲ.(6)ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量,则合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的反应热ΔH=946 kJ/mol+3×436 kJ/mol-2×3×390.8 kJ/mol=-90.8kJ·mol-1,即N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是放出90.8kJ能量。
2NH3(g)的反应热ΔH=946 kJ/mol+3×436 kJ/mol-2×3×390.8 kJ/mol=-90.8kJ·mol-1,即N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是放出90.8kJ能量。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
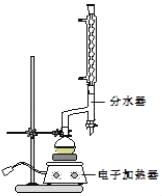
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.