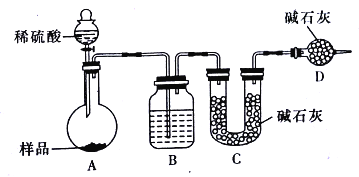
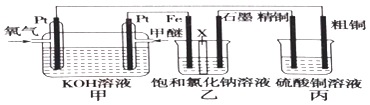
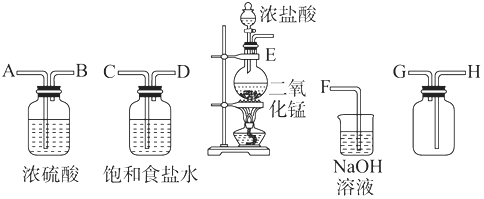
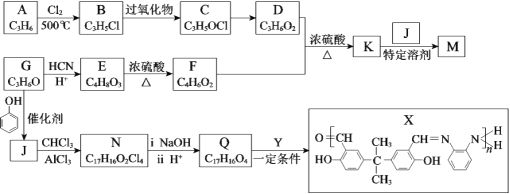
题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
完成下列填空:
(1)生产过程中温度控制在400℃~500℃,目的是__________________________________;该反应无需加压的原因是____________________________________________________。
(2)上述反应在密闭容器中达到化学平衡状态的标志为______________________________。
(3)上述反应的平衡常数表达式为__________________________________,随着温度升高,平衡常数__________________(选填“增大”、“减小”或“不变”)。
(4)接触法生产硫酸尾气中含有SO2,可以采用氨水吸收,生成(NH4)2SO3与NH4HSO3的混合溶液。反应所得(NH4)2SO3又可以将NO2转化为N2和(NH4)2SO4。
① 写出生成NH4HSO3的化学方程式__________________________________________。
② 书写NO2与(NH4)2SO3反应的化学方程式,标出该反应中电子转移的方向和数目__________________________________。
【答案】 确保催化剂的活性最高 该条件下SO2的转化率已经很高,增大压强对提高SO2的转化率无显著影响,反而会增加成本 容器中气体的平均相对分子质量不随时间而变化(合理即可) K=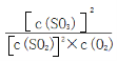 减小 NH3+H2O+SO2=NH4HSO3
减小 NH3+H2O+SO2=NH4HSO3 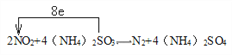
【解析】(1)考查化学反应条件的控制,此反应的正反应是放热反应,需要加入催化剂,因此控制温度在400℃~500℃的目的时保证催化剂的催化效率最高;因为在常压下,SO2的转化率已经很高,再增大压强,SO2的转化率提高不大,反而增加成本;(2)考查化学平衡状态的判断,容器中气体的平均相对分子质量不随时间而变化、组分的浓度不再改变等;(3)考查化学平衡常数,以及影响化学平衡常数的因素,根据化学平衡常数的定义,此反应的化学平衡常数K=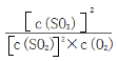 ;化学平衡常数只受温度的影响,因为此反应的正反应是放热反应,因此升高温度,化学平衡常数减小;(4)考查化学反应方程式的书写、电子转移方向和数目,①SO2在某些性质上与CO2的性质相似,向氨水中通入SO2,先发生SO2+2NH3+H2O=(NH4)2SO3,继续通入SO2,则发生(NH4)2SO3+SO2+H2O=2NH4HSO3,因此生成NH4HSO3的总反应是NH3+H2O+SO2=NH4HSO3;②根据题中信息,(NH4)2SO3+NO2→N2+(NH4)2SO4,根据化合价升降法进行配平,得出2NO2+4(NH4)2SO3=N2+4(NH4)2SO4,表示转移电子方向和数目为
;化学平衡常数只受温度的影响,因为此反应的正反应是放热反应,因此升高温度,化学平衡常数减小;(4)考查化学反应方程式的书写、电子转移方向和数目,①SO2在某些性质上与CO2的性质相似,向氨水中通入SO2,先发生SO2+2NH3+H2O=(NH4)2SO3,继续通入SO2,则发生(NH4)2SO3+SO2+H2O=2NH4HSO3,因此生成NH4HSO3的总反应是NH3+H2O+SO2=NH4HSO3;②根据题中信息,(NH4)2SO3+NO2→N2+(NH4)2SO4,根据化合价升降法进行配平,得出2NO2+4(NH4)2SO3=N2+4(NH4)2SO4,表示转移电子方向和数目为 。
。

【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
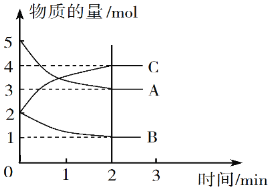
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。