题目内容
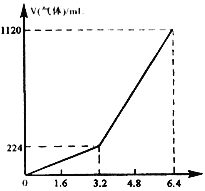
【题目】将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
⑴3.2 g固体A中所含的物质有______________。
⑵3.2 g固体A中各物质的物质的量分别为______________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为______________(忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=______________mL(用含m的代数式表示)。
【答案】Fe、FeS n(Fe)=0.01 mol,n(FeS)=0.03 mol c(H2S)=0.1 mol/L V=(280m-672)mL
【解析】
⑴固体A的组成有3种情况:①只有FeS,②Fe过量、有FeS和Fe,③S过量、有FeS和S。由题意可知,固体A加入到盐酸中可完全溶解,则排除S过量。再由已知可知,固体A与盐酸反应同时生成了H2和H2S,所以固体A的组成为Fe和FeS。答案为Fe、FeS。
⑵当m=3.2 g时,无H2S放出,此时H2S刚好形成饱和溶液。
n(Fe)=n(H2)=![]() =0.01 mol,根据质量守恒:n(FeS)=
=0.01 mol,根据质量守恒:n(FeS)=![]() =0.03 mol;c(H2S)=
=0.03 mol;c(H2S)=![]() =0.1 mol/L。
=0.1 mol/L。
答案为n(Fe)=0.01 mol,n(FeS)=0.03 mol,c(H2S)=0.1 mol/L。
⑶利用到的主要关系式为:Fe~H2↑、FeS~H2S↑均为1:1。因为在3.2 g固体A中含Fe和FeS共0.04 mol,产生H2和H2S共0.04 mol,其中0.03mol H2S全部溶解在水中。
则m g固体A中含有Fe和FeS共![]() ×0.04mol,
×0.04mol,
所以收集到的气体体积V=(![]() ×0.04mol-0.03mol)×22.4L/mol×103mL/L=(280m-672)mL。答案为V=(280m-672)mL。
×0.04mol-0.03mol)×22.4L/mol×103mL/L=(280m-672)mL。答案为V=(280m-672)mL。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】A~D是中学实验中常见的几种温度计装置示意图。
(1)请从①~⑥中选取出必须使用温度计的实验,选择A、B装置适合的实验填写空格。
①酒精和浓硫酸混合加热制乙烯,②电石跟水反应制乙炔,③分离硝基苯和硝酸的混合物,④苯和溴的取代反应,⑤石油分馏实验,⑥浓盐酸和二氧化锰混合加热制氯气
A | B | C |
|
|
|
_____________ | ___________ |
①中浓硫酸和酒精的混合顺序为_________________________,写出实验室制乙烯的化学方程式____________________________。
②中为了获得稳定的气流常用___________代替水,写出实验室制乙炔的化学方程式___________________________________。
(2)选用装置C做苯的硝化实验,D中长玻璃管的作用是_________________________。