题目内容
【题目】下列解释事实的化学用语错误的是
A.闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+=CuS + Zn2+
B.0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e-=H2↑+ 2OH-
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e-= Fe3+
【答案】D
【解析】
A.溶解度大的物质可以转化为溶解度小的物质,溶解度ZnS>CuS,则闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS),反应的离子方程式为ZnS+Cu2+=CuS+Zn2+,故A正确;
B.0.1mol/L醋酸溶液的pH约为3,说明醋酸为弱酸,部分电离,电离方程式为CH3COOHCH3COO-+H+,故B正确;
C.电解NaCl溶液时,阴极上水得电子生成氢气和氢氧根离子,离子方程式为2H2O+2e-=H2↑+2OH-,阴极区溶液pH增大,故C正确;
D.钢铁发生吸氧腐蚀时,负极上Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故D错误;
故选D。

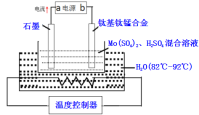
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。

SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
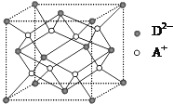
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。