题目内容
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。

【答案】d ![]() N> O> C 4种 F—HF、F—HO、O—HF、O—HO SiO2>CO2 平面三角形 sp2杂化 SO3 H4Cu3Au
N> O> C 4种 F—HF、F—HO、O—HF、O—HO SiO2>CO2 平面三角形 sp2杂化 SO3 H4Cu3Au ![]() 2:3:1
2:3:1
【解析】
a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周 期表中第4 纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu,据此分析。
a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同, 核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周 期表中第4 纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu。
(l)d为Ti元素,属于d区的元素,基态原子的价电子排布3d24s2,故其基态原子的价电排布图为![]() ;
;
(2)与b同周期相邻元素分别为C、O,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为:N> O> C;
(3)c的氢化物为HF,水溶液中存在的氢键有F—HF、F—HO、O—HF、O—HO,共4种;
(4)a与其相邻同主族元素的最高价氧化物分别为CO2、SiO2,CO2属于分子晶体,SiO2属于原子晶体,共价键的键能远大于分子间作用力,故熔点高低顺序为SiO2>CO2。a元素最高价氧化物水化物对应的正盐酸根离子为CO32- ,离子中C原子价层电子对数3+![]() =3,C上没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为sp2杂化;与CO32-互为等电子体的一种分子为SO3等;
=3,C上没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为sp2杂化;与CO32-互为等电子体的一种分子为SO3等;
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在晶胞中Cu原子处于面心,Au原子处于顶点,该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,金刚石晶胞结构为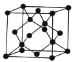 ,则形成的晶体中晶胞中,H原子有4个, Cu原子数目为6×
,则形成的晶体中晶胞中,H原子有4个, Cu原子数目为6×![]() =3,Au原子数目为8×
=3,Au原子数目为8×![]() = 1,该晶体储氢后的化学式为H4Cu3Au;若该晶体的相对分子质量为M,晶胞质量为
= 1,该晶体储氢后的化学式为H4Cu3Au;若该晶体的相对分子质量为M,晶胞质量为![]() g;晶体密度为ag/cm3,则晶胞体积为
g;晶体密度为ag/cm3,则晶胞体积为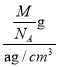 =
=![]() ;
;
(6)在C的层状结构中,我们以一个六元环为研究对象,由于碳原子为三个六元环共用,即属于每个六元环的碳原子数为6×![]() =2;另外碳碳键数为二个六元环共用,即属于每个六元环的碳碳键数为6×
=2;另外碳碳键数为二个六元环共用,即属于每个六元环的碳碳键数为6×![]() =3,故碳原子数、C—C键数、六元环数之比为2:3:1。
=3,故碳原子数、C—C键数、六元环数之比为2:3:1。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀产生,苯层呈紫红色 | Cu2+有氧化性,白色沉淀可能为CuI |
C | 向蛋白质溶液中分别加入甲醛、(NH4)2SO4饱和溶液 | 均有白色沉淀生成 | 蛋白质均发生了变性 |
D | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液 | 出现血红色 | 反应2Fe3++2I |
A.AB.BC.CD.D