题目内容
12.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )| A. | 加适量的醋酸钠晶体后,两溶液的c(H+)均减小 | |
| B. | 使温度都升高20℃后,两溶液的c(H+)均不变 | |
| C. | 加水稀释2倍后,两溶液的c(H+)均增大 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
分析 盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
解答 解:A.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液中c(H+)减小,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液中c(H+)减小,故A正确;
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸中c(H+)不变,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,故B错误;
C.c(H+)相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,故C错误;
D.c(H+)相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误;
故选A.
点评 本题考查了弱电解质电离,以及影响弱电解质的电离平衡的因素,注意c(H+)相同醋酸和盐酸两种溶液,醋酸的浓度大,题目难度一般.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
7.下列各组元素中,原子半径依次增大的是( )
| A. | Al、Si、P | B. | I、Br、Cl | C. | O、S、Na | D. | Mg、Ca、Ba |
20.25℃时,水的电离达到平衡:H2O?H++OH-,△H>0,下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量固体硫酸氢钠,溶液温度不变,则c(H+)增大,Kw不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
7.从植物中分离出的活性化合物zeylastral的结构简式如图所示.下列说法不正确的是( )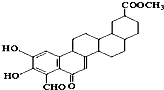

| A. | 该有机物可发生取代反应、加成反应、还原反应、氧化反应等 | |
| B. | 能与FeCl3溶液显色、银氨溶液反应生成光亮的银镜 | |
| C. | 1mol zeylastral最多与5molH2发生反应 | |
| D. | 1mol zeylastral最多可与3molBr2发生反应、3molNaOH发生反应 |
17.为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源,以下做法不能提高燃料效率的是( )
| A. | 煤的汽化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 将煤压成煤球使用 | D. | 将煤粉燃烧 |
1.关于如图所示装置的叙述.正确的是( )
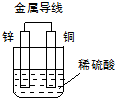

| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 氢离子在铜片表面被氧化 |
2.下列分子结构中,原子的最外层电子满足8电子稳定结构的是( )
| A. | SO3 | B. | PF5 | C. | CCl4 | D. | NO2 |