题目内容
2.下列分子结构中,原子的最外层电子满足8电子稳定结构的是( )| A. | SO3 | B. | PF5 | C. | CCl4 | D. | NO2 |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A、SO3中,S属于第ⅥA族元素,S元素的族序数+成键数=6+6=12,所以不满足8电子结构,故A错误;
B、PF5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故B错误;
C、CCl4中,C元素位于第IVA族,则4+4=8,Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,都满足最外层8电子结构,故C正确;
D、NO2中,N原子的最外层电子为:5+4=9,O原子的最外层电子为:6+|-2|=8,不能都满足8电子稳定结构,故D错误.
故选C.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
相关题目
12.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加适量的醋酸钠晶体后,两溶液的c(H+)均减小 | |
| B. | 使温度都升高20℃后,两溶液的c(H+)均不变 | |
| C. | 加水稀释2倍后,两溶液的c(H+)均增大 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
13.下列关于晶体的说法一定正确的是( )
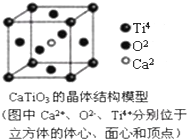

| A. | 分子晶体中都存在共价键 | |
| B. | CaTiO3晶体中每个Ti4+和12个O2-相紧邻 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
17.常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A. | 苯 乙酸乙酯 乙醇 | B. | AgNO3 KNO3 Na2CO3 | ||
| C. | MnO2 CuO FeO | D. | (NH4)2SO4 K2SO4 NH4Cl |
7.下列应用不涉及氧化还原反应的是( )
| A. | 工业上制粗硅并提纯 | |
| B. | 用FeCl3溶液作为“腐蚀液”刻蚀电路铜板 | |
| C. | 实验室制CO2 | |
| D. | 用Na2O2作潜水艇的供氧剂 |
14.溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)═C(CH3COO-)+C(CH3COOH) |
11.下列叙述中正确的是( )
| A. | Ca(ClO)2溶液:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合,溶液呈酸性:c(HX)>c(X-) | |
| C. | 中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1:2 | |
| D. | 25℃时,若10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好完全反应,则a+b=13 |
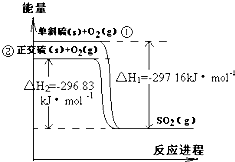 单斜硫和正交硫转化为二氧化硫的能量变化图如图,回答下列问题:
单斜硫和正交硫转化为二氧化硫的能量变化图如图,回答下列问题: A~G是前四周期除稀有气体之外原子序数依次增大的七种元素.A与其它元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.请结合题目回答以下问题:
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素.A与其它元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.请结合题目回答以下问题: .
.