题目内容
3.实验室用电石和水反应制取的乙炔气体中含有少量H2S气体,为了净化和检验乙炔气体,并计算乙炔的体积,按下列要求填空:(1)试从如图所示装置中选用几种必要的装置,把它们连成一套装置,这些被选用的装置接口编号连接顺序是C I J G H F E D.
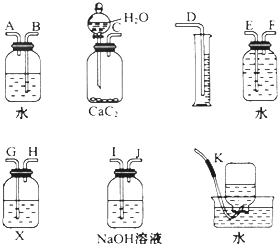
(2)实验室能否用启普发生器制乙炔?不能.(填“能”或“不能”)
(3)为了得到比较平稳的乙炔气流,常可用饱和食盐水代替水.
(4)NaOH溶液的作用是除去乙炔中的气体杂质.
(5)X溶液应为溴的四氯化碳溶液.
分析 (1)气体制备装置、净化装置(除硫化氢)、检验装置、排水测体积的装置;
(2)实验室不能用启普发生器制取乙炔气体;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应;
(4)乙炔中常含有其它酸性气体杂质,为验证乙炔的性质不被干扰,需要除去;
(5)乙炔与溴发生加成反应使其褪色,利用此性质检验乙炔的存在.
解答 解:(1)实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,则需要的装备依次为:气体制备装置、净化装置(除硫化氢)、检验装置、排水测体积的装置,则装置接口的连接顺序为C I J G H F E D;故答案为:C I J G H F E D;
(2)此反应大量放热,生成的氢氧化钙是糊状物,反应很剧烈,应选用分液漏斗,以便控制水的流速,故实验室不能用启普发生器制取乙炔气体,应用分液漏斗和平底烧瓶,故答案为:不能;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的气流,用饱和食盐水代替水,故答案为:饱和食盐水;
(4)由于乙炔中含有其它杂质气体,干扰乙炔的验证,故利用氢氧化钠溶液除去气体杂质,故答案为:除去乙炔中的气体杂质;
(5)乙炔与溴的四氯化碳溶液反应使其褪色,故溶液X为溴的四氯化碳溶液,故答案为:溴的四氯化碳溶液.
点评 本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.

练习册系列答案
相关题目
18.在碱性溶液中能大量共存离子组是( )
| A. | K+、Cu2+、Na+、Cl- | B. | K+、Na+、NO3-、CO32- | ||
| C. | Na+、HCO3-、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
19.下列关于分子间作用力的说法,正确的是( )
| A. | 分子间作用力是一种比较弱的化学键 | |
| B. | 氯化钠晶体中不存在范德华力 | |
| C. | 锂、钠、钾、铷、铯的熔点越来越低是因为分子间作用力越来越弱 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
16.下列变化中,一定伴随着化学变化的是( )
| A. | 加热碘,收集到紫黑色固体 | |
| B. | 将NaCl固体溶于水后离子键被破坏 | |
| C. | 将CCl4加入溴水中,观察到CCl4成橙色 | |
| D. | 将H2O2滴加在MnO2中,可收集到无色气体 |
3.如图所示为4种氨基酸的结构式,则夏利叙述正确的是( )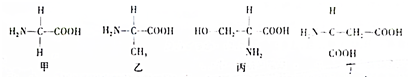
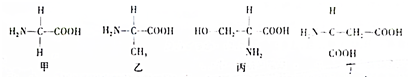
| A. | 构成氨基酸的元素只有C、H、O、N4种 | |
| B. | 氨基酸丙和丁的R基分别是-NH3和-CH2-COOH | |
| C. | R基中可以有氨基或羧基 | |
| D. | 组成水稻的氨基酸包括必需氨基酸和非必需氨基酸 |
15.下列各组物质中,符合前者为混合物,后者为单质的是( )
| A. | Na2CO3•10H2O Na2CO3 | B. | 冰水混合物 液氮 | ||
| C. | 石油 液氢 | D. | 碘酒 干冰 |
12.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加适量的醋酸钠晶体后,两溶液的c(H+)均减小 | |
| B. | 使温度都升高20℃后,两溶液的c(H+)均不变 | |
| C. | 加水稀释2倍后,两溶液的c(H+)均增大 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
13.下列关于晶体的说法一定正确的是( )
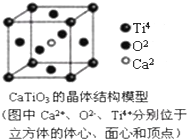

| A. | 分子晶体中都存在共价键 | |
| B. | CaTiO3晶体中每个Ti4+和12个O2-相紧邻 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |