题目内容
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
【答案】-660 0.16mol/(L·min) 0.53 < b
【解析】
(1)根据盖斯定律,将已知的热化学方程式进行叠加,可得要求的反应的反应热;
(2)①结合CO2的转化率,计算CO2的转化量,然后根据化学反应速率是定义计算v(CO2),再根据物质反应速率与化学计算量关系计算v(CH3OH),根据平衡常数的定义式计算反应的化学平衡常数;
②反应开始时,两个容器的容积相同,容器内的气体的物质的量相同,A为恒温恒容,B为恒温、恒压,结合反应的正反应是气体体积减小的反应及压强对化学反应速率的影响分析;
③若对于A容器,若反应的v正>v逆,则反应未达到平衡,正向进行。
(1)①2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1,
2CO2(g) △H1=-566kJ·molˉ1,
②H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1,
H2(g)+CO2(g) △H2=-41kJ·molˉ1,
③CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
根据盖斯定律,①+②×2+①×![]() ,整理可④式CO(g)+2H2(g)+
,整理可④式CO(g)+2H2(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=-767kJ·molˉ1;
CO2(g)+2H2O(g) △H=-767kJ·molˉ1;
④-③,整理可得CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=-660kJ·molˉ1;
CO2(g)+2H2O(g) △H=-660kJ·molˉ1;
(2)对于A容器,反应在恒温、恒容条件下进行,反应开始时n(CO2)= 4.0mol,由于反应进行到5min时CO2的转化率是0.40,所以反应的CO2的物质的量为△n(CO2)= 4.0mol×0.4=1.6mol,所以用CO2表示的化学反应v(CO2)= =0.16mol/(L·min)。根据物质反应时化学反应的速率比等于化学方程式中相应物质的化学计量数的比可知:v(CH3OH)=v(CO2)=0.16mol/(L·min);
=0.16mol/(L·min)。根据物质反应时化学反应的速率比等于化学方程式中相应物质的化学计量数的比可知:v(CH3OH)=v(CO2)=0.16mol/(L·min);
根据方程式CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)可知CO2反应了1.6mol,则会同时有4.8molH2发生反应,反应达到平衡时CO2的物质的量是2.4mol,H2的物质的量是2mol,反应产生1.6mol CH3OH和1.6molH2O,由于反应容器的容积是2L,因此各种物质的平衡浓度分别是:c(CO2)=1.2mol/L,c(H2)=1mol/L,c(CH3OH)=c(H2O)=0.8mol/L,则该反应达到平衡时该反应的化学平衡常数K=
CH3OH(g)+H2O(g)可知CO2反应了1.6mol,则会同时有4.8molH2发生反应,反应达到平衡时CO2的物质的量是2.4mol,H2的物质的量是2mol,反应产生1.6mol CH3OH和1.6molH2O,由于反应容器的容积是2L,因此各种物质的平衡浓度分别是:c(CO2)=1.2mol/L,c(H2)=1mol/L,c(CH3OH)=c(H2O)=0.8mol/L,则该反应达到平衡时该反应的化学平衡常数K=![]() =0.53;
=0.53;
②反应开始时,两个容器的容积相同,容器内的气体的物质的量相同,A为恒温恒容,B为恒温、恒压,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)的正反应是气体体积减小的反应,随着反应的进行,容器内气体的压强减小,要维持体系的压强不变,则B容器相当于A容器反应达到平衡后,对反应体系增大压强,增大压强,物质的浓度增大,化学反应速率增大,所以反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)<v(B)。
CH3OH(g)+H2O(g)的正反应是气体体积减小的反应,随着反应的进行,容器内气体的压强减小,要维持体系的压强不变,则B容器相当于A容器反应达到平衡后,对反应体系增大压强,增大压强,物质的浓度增大,化学反应速率增大,所以反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)<v(B)。
③a.该反应的正反应为放热反应,无论是反应正向进行还是反应达到平衡状态,体系内的压强都比反应开始时压强大。所以不能根据体系压强增大判断反应正向进行,v正>v逆,a错误;
b.该反应的正反应是气体体积减小的反应,若反应正向进行,则气体的物质的量减小,气体的平均相对分子质量增大,故可据此判断v正>v逆,b正确;
c.根据方程式可知:反应正向进行时,断裂H-H键的数目是形成C-O键数目的3倍,不可能是形成C-O键数目的2倍,c错误;
d.在任何条件下,v正(H2)=3v正(CO2),若v逆(CO2)=v正(H2),则v逆(CO2)=3v正(CO2),反应正向进行,所以v正<v逆,d错误;
故合理选项是b。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
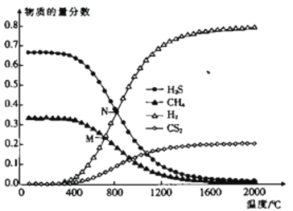
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%