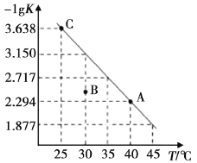
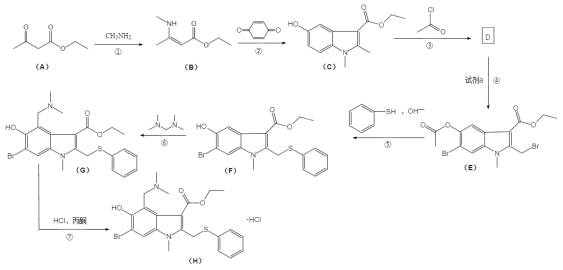
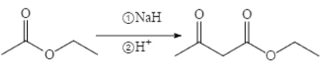
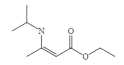
题目内容
【题目】氯化铁是黑棕色晶体,沸点为315℃,有强烈的吸水性,易潮解。某小组同学对无水FeCl3能否分解产生Cl2,进行了如下实验探究。
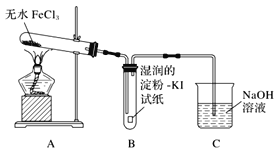
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,乙同学认为不能得出此结论,理由是_______。
(2)乙同学提出了改进意见,用如图所示装置进行实验:
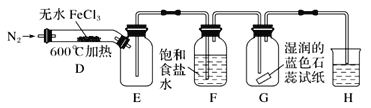
装置H中的试剂为________。装置F中饱和食盐水的作用是________。实验结束后,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入_________(填化学式)溶液,若观察到_____,说明FeCl3已经分解完全。
(3)实验后把镁条投入装置F的溶液中,发生的现象是___,其原因是(结合离子方程式)解释_______。
【答案】该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气 NaOH溶液 除去FeCl3蒸气 KSCN 溶液未变红色 有气泡和红褐色沉淀产生 Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀
Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀
【解析】
该小组同学对无水FeCl3能否分解产生Cl2,进行试验探究,甲同学想通过装置B中湿润的淀粉KI试纸变蓝来证明无水FeCl3能分解产生Cl2,他认为的原理是: Cl2有氧化性,会把I-氧化为I2,I2遇到淀粉显蓝色。但是在第一套装置中,有氧化性的除了氯气还有空气中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸汽,他们都可以把I-氧化为I2。这样看来,第一套装置不够严密,可以从上述角度出发来改进装置,即乙同学改进的装置。通入N2可以排出装置内的空气,避免氧气的干扰,E是安全瓶,F可以吸收FeCl3蒸气,G用来检验氯气,若出现湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,H是尾气处理装置,可以用NaOH溶液吸收氯气。判断FeCl3是否完全分解,可以通过检验Fe3+来检验。
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,这个结论不够严密,因为该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气。
答案为:该实验条件下能将I-氧化为I2的物质,除了无水FeCl3分解产生的Cl2外,还有装置中的氧气,以及沸点较低的FeCl3受热变成的FeCl3蒸气。
(2)装置H中的试剂为NaOH溶液,吸收剩余的氯气。氯化铁沸点为315℃,加热到600℃会产生FeCl3蒸气,干扰试验,所以用装置F中饱和食盐水吸收FeCl3蒸气。,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入KSCN溶液,若溶液未变红色说明溶液中不含Fe3+,FeCl3已经分解完全。
答案为:NaOH溶液;除去FeCl3蒸气;KSCN;溶液未变红色;
(3)装置F的溶液中含有FeCl3,FeCl3水解时溶液显酸性,水解的离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,加入镁条,镁可以和H+反应生成氢气,从而使水解平衡正向移动,促进Fe3+完全水解,生成Fe(OH)3沉淀。
Fe(OH)3+3H+,加入镁条,镁可以和H+反应生成氢气,从而使水解平衡正向移动,促进Fe3+完全水解,生成Fe(OH)3沉淀。
答案为:有气泡和红褐色沉淀产生;Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀;
Fe(OH)3+3H+,Mg与H+反应,Mg+2H+=Mg2++H2↑产生氢气,pH升高,促进Fe3+完全水解,生成Fe(OH)3沉淀;

 初中暑期衔接系列答案
初中暑期衔接系列答案