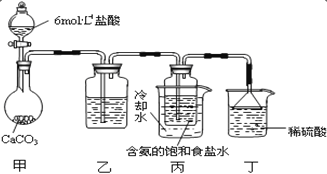
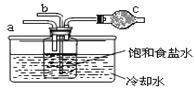
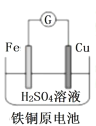
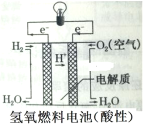
��Ŀ����
����Ŀ�����淴Ӧ 2NO2(g)![]() N2O4 (g)�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
N2O4 (g)�����������ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
����λʱ�������� n mol N2O4 ��ͬʱ���� 2n mol NO2
����λʱ�������� n mol N2O4��ͬʱ���� 2n mol NO2
����������ƽ����Է����������ٸı��״̬
������������ɫ���ٸı��״̬
����NO2��N2O4�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��1 ��״̬
A.�٢ܢ�B.�ڢ�C.�٢ۢ�D.�٢ڢۢܢ�
���𰸡�C
��������
�ٵ�λʱ��������nmolN2O4��ͬʱ����2nmolNO2��ͬʱ����nmolN2O4�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬���ʢ���ȷ��
�����۷�Ӧ�Ƿ�ﵽƽ��״̬�����ڵ�λʱ��������nmolN2O4��ͬʱ����2nmolNO2�����ܾݴ��ж�ƽ��״̬���ʢڴ���
�۷�Ӧǰ���������������䡢���ʵ�����С����������ƽ��Ħ������������������ƽ����Է����������ٸı��ʱ�������ʵ����ʵ������䣬��Ӧ�ﵽƽ��״̬���ʢ���ȷ��
�ܻ���������ɫ���ٸı�ʱ����������Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬���ʢ���ȷ��
�����۷�Ӧ�Ƿ�ﵽƽ��״̬������NO2��N2O4�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��1�����ܾݴ��ж�ƽ��״̬���ʢݴ���
�٢ۢ���ȷ���ʴ�ΪC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ȩ������ˮ���������л��ܼ����ܶ�Լ����ˮ���ܶȣ��ڼ��������·����绯��Ӧ�����Ʊ����״�����ˮ���ܽ�Ȳ����������л��ܼ����ܶ�Լ����ˮ���ܶȣ��ͱ����ᡣ��Ӧԭ�����£�2C6H5CHO+NaOH��C6H5CH2OH+C6H5COONa��C6H5COONa+HCl��C6H5COOH+NaCl���й������������������
����ȩ | ���״� | ������ | �� | |
�е�/�� | 178 | 205 | 249 | 80 |
�۵�/�� | 26 | ��15 | 12 | 5.5 |
��������ˮ�е��ܽ�� | ||
17�� | 25�� | 100�� |
0.21 g | 0.34 g | 5.9 g |
ʵ���������£�
��1���ڢٲ�����������1Сʱ����ͼ1�������м��Ⱥ̶�װ��δ��������������B��Ϊ����C��Ч������B��˵��ԭ��________��
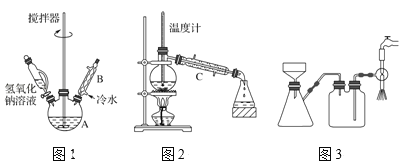
��2���������йط�Һ©����ʹ�ò���ȷ����___��
A����Һ©����ʹ��֮ǰ�������Ƿ�©ˮ
B����Һ©���ڵ�Һ�岻�ܹ��࣬����������
C�������Һ©����������̨�Ͼ��ã��ֲ���������������з�Һ
D����Һʱ���²�Һ�����������ر���������һ���ձ��ٴ�����ʹ�ϲ�Һ������
��3���������÷�ˮԡ���������ٽ��в����ܣ���ͼ2�����ռ�___�����֡�ͼ2����һ�����Դ�����ȷ��Ӧ��Ϊ_______��
��4������ʱ����ͼ3���ձ��б����ᾧ��ת�벼��©��ʱ�������ϻ�ճ���������壬��___��ϴ�����ϲ����ľ��壬������ɺ�ϴ�Ӿ��塣
��5���õ�����ƽȷ��ȡ0.244 0 g��������Ʒ����ƿ�У���100 mL����ˮ�ܽ⣨��Ҫʱ���Լ��ȣ�������0.100 0 molL��1�ı�NaOH��Һ�ζ���������NaOH��Һ19.20 mL��������Ʒ�Ĵ���Ϊ___%������4λ��Ч���֣���
����Ŀ�������¶���,������������ĺ����ܱ������У���Ӧ2CO2(g)+ 6H2(g)![]() C2H5OH(g)+3H2O(g)��ƽ�⡣����˵����ȷ����
C2H5OH(g)+3H2O(g)��ƽ�⡣����˵����ȷ����
���� | �¶�/K | ���ʵ���ʼŨ��(mol��L-1) | ���ʵ�ƽ��Ũ(mol��L-1) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
�� | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
�� | 500 | 0.40 | 0.60 | 0 | 0 | |
�� | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. �÷�Ӧ����ӦΪ���ȷ�Ӧ
B. ��ƽ��ʱ,�ס��������ڣ�2c(C2H5OH ,��)��c(C2H5OH ,��)
C. ��ƽ��ʱ,�������е��淴Ӧ���ʱ��������еĴ�
D. ��ƽ��ʱ,ת���ʣ�a(CO2,��)+a(C2H5OH,��)>1