题目内容
【题目】室温下,把下列各题的结果填在横线上。
(1)c(OH-)=1×10-3mol/L的溶液的pH=___________________
(2)0.01mol/L HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=_________________
(3)某溶液由水电离出H+的物质的量的浓度c(H+)= 1×10-5mol/L,则该溶液可以是______(填“硫酸”或“氯化铵”或 “氢氧化钠” 或“氯化钠”)溶液
(4)将0.39g过氧化钠溶于足量水中并配成100 mL溶液,则溶液的pH=_____________
(5)0. 12mol/L HCl溶液与0.1mol/L 的NaOH溶液等体积混合,混合液的pH=___________
【答案】11 1×10-12mol/L 氯化铵 13 2
【解析】
(1)根据pH的计算公式进行计算;
(2)0.01mol/LHNO3溶液中c(H+)=0.01mol/L,溶液中氢氧根离子只能由水电离,所以由水电离的氢离子浓度等于溶液中c(OH-),根据Kw计算溶液中c(OH-);
(3)水的电离平衡:H2O![]() H++OH-,由于c(OH-)=1×10-5mol/L>1×10-7mol/L,说明水的电离被促进;NH4Cl中含有弱碱阳离子NH4+,可结合水电离的OH-,使平衡正向移动,符合题意;
H++OH-,由于c(OH-)=1×10-5mol/L>1×10-7mol/L,说明水的电离被促进;NH4Cl中含有弱碱阳离子NH4+,可结合水电离的OH-,使平衡正向移动,符合题意;
(4)由n(NaOH)=2n(Na2O2)=0.005mol×2=0.01mol可知,故形成的氢氧化钠溶液的浓度为0.01mol/0.1L=0.1mol/L,溶液的pOH=-lg[c(OH-)]=-lg0.1=1,所以溶液的pH=14-1=13;
(5)根据酸和碱混合计算溶液的pH值。
(1)c(OH-)=1×10-3mol/L的溶液的pOH=-lg[c(OH-)]=-lg1×10-3=3,所以溶液的pH=14-3=11,故答案为:11。
(2)0.01mol/LHNO3溶液中c(H+)=0.01mol/L,溶液中氢氧根离子只能由水电离,Kw=c(H+)×c(OH-)=1×10-14,溶液中c(OH-)=1×10-14/0.01=1×10-12(mol/L),由水电离的氢离子浓度等于溶液中c(OH-),故溶液中由水电离的氢离子浓度为1×10-12mol/L,
故答案为:1×10-12mol/L。
(3)水的电离平衡:H2O![]() H++OH-,由于c(OH-)=1×10-5mol/L>1×10-7mol/L,说明水的电离被促进;NH4Cl中含有弱碱阳离子NH4+,可结合水电离的OH-,使平衡正向移动,符合题意,而H2SO4可电离出H+抑制水的电离,NaOH可电离出OH-抑制水的电离,NaCl对水的电离平衡无影响,
H++OH-,由于c(OH-)=1×10-5mol/L>1×10-7mol/L,说明水的电离被促进;NH4Cl中含有弱碱阳离子NH4+,可结合水电离的OH-,使平衡正向移动,符合题意,而H2SO4可电离出H+抑制水的电离,NaOH可电离出OH-抑制水的电离,NaCl对水的电离平衡无影响,
故答案为:氯化铵。
(4)0.39g过氧化钠的物质的量为0.39g÷78g/mol=0.005mol,由化学方程式2Na2O2+2H2O═4NaOH+O2↑及钠元素守恒可知:n(NaOH)=2n(Na2O2)=0.005mol×2=0.01mol,故形成的氢氧化钠溶液的浓度为0.01mol/0.1L=0.1mol/L,溶液的pOH=-lg[c(OH-)]=-lg0.1=1,所以溶液的pH=14-1=13,故答案为:13。
(5)NaOH与HCl以1:1发生中和反应:NaOH+HCl=NaCl+H2O,现在盐酸浓度为0.12mol/L,氢氧化钠浓度为0.1mol/L,且溶液体积相等,设盐酸和氢氧化钠溶液的体积都是VL,则完全反应后,溶液中盐酸有剩余,剩余的盐酸的浓度为:(0.12mol/L×VL-0.1mol/L×VL)/2VL=0.01mol/L,即:c(HCl)剩余=0.01mol/L,则c(H+)剩余=0.01mol/L,pH=-lg[c(H+)]=-lg0.01=2。
故答案为:2。

 阅读快车系列答案
阅读快车系列答案【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
【题目】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________mol·L-1 (不能做近似计算)。
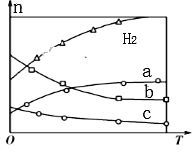
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(2)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.3v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)c(N2)c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________