题目内容
【题目】SiO2是一种化工原料,可以制备一系列物质,下列说法正确的是
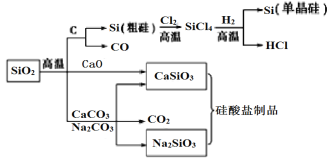
A. 图中所有反应都不属于氧化还原反应
B. 硅酸盐的化学性质稳定,常用于制造光导纤维
C. 可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸盐
D. 普通玻璃是由纯碱、石灰石和石英制成的,其熔点很高
【答案】C
【解析】
图中SiO2与CaO、CaCO3、Na2CO3反应不属于氧化还原反应,SiO2与C、Si与Cl2、SiCl4与H2的反应属于氧化还原反应。
A项、化学反应前后有元素化合价变化的一定是氧化还原反应,二氧化硅与碳反应生成硅单质和粗硅与氯气的反应是氧化还原反应,故A错误;
B项、光导纤维的成分是二氧化硅,不是硅酸盐,故B错误;
C项、碳酸钙溶于盐酸生成氯化钙和水以及二氧化碳,二氧化硅和盐酸不反应,可以用盐酸除去石英(主要成分为SiO2)中混有的少量碳酸钙,故C正确;
D项、玻璃是由纯碱、石灰石和石英制成的,玻璃属于混合物,没有固定的熔点,故D错误。
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(2)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.3v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)c(N2)c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________