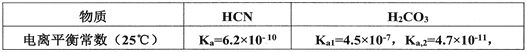题目内容
【题目】下图中A、B、C、D分别为AlCl3、NaOH、NH4HSO4、Na2CO3溶液,实验过程和记录如下图所示(无关物质已经略去):
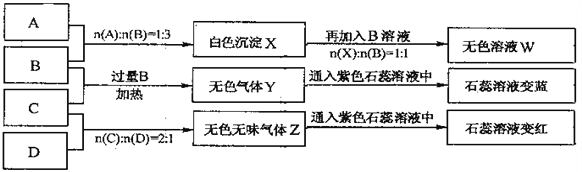
请回答:
(1)W的溶液加热蒸干并灼烧最后所得固体为__________。
(2)D溶液pH___(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是_________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者_____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____。
【答案】 NaAlO2 大于 CO32-+H2O![]() HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)> c (SO42-)> c (NH4+)> c (H+) =C(OH-)
HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)> c (SO42-)> c (NH4+)> c (H+) =C(OH-)
【解析】本题考查盐类水解、离子浓度大小顺序,A和B按1:3混合,发生Al3++3OH-=Al(OH)3↓,即X为氢氧化铝沉淀,再加入B溶液,按1:1混合,发生Al(OH)3+OH-=AlO2-+2H2O,即W的溶液为NaAlO2,B和C,B过量且加热,发生NH4++OH-![]() NH3↑+H2O,C和D按2:1混合,发生2H++CO32-=CO2↑+H2O,即Z为CO2,(1)根据上述分析,W为NaAlO2,AlO2-+2H2O
NH3↑+H2O,C和D按2:1混合,发生2H++CO32-=CO2↑+H2O,即Z为CO2,(1)根据上述分析,W为NaAlO2,AlO2-+2H2O![]() Al(OH)3+OH-,盐类水解属于吸热反应,升高温度,促进水解,但NaOH属于难挥发性碱,因此加热蒸干并灼烧最后得到固体是NaAlO2;(2)D为Na2CO3,碳酸钠属于强碱弱酸盐,CO32-发生水解,存在CO32-+H2O
Al(OH)3+OH-,盐类水解属于吸热反应,升高温度,促进水解,但NaOH属于难挥发性碱,因此加热蒸干并灼烧最后得到固体是NaAlO2;(2)D为Na2CO3,碳酸钠属于强碱弱酸盐,CO32-发生水解,存在CO32-+H2O![]() HCO3-+OH-,造成溶液中c(OH-)>c(H+),溶液显碱性,即pH>7;(3)AlCl3、NH4HSO4溶液显酸性,AlCl3溶液显碱性是因为是Al3+水解造成,NH4HSO4溶液显酸性,发生NH4HSO4=NH4++H++SO42-,相同浓度时,NH4HSO4中c(H+)大于AlCl3溶液中c(H+),即pH大小顺序是c(NH4HSO4)<c(AlCl3),NaOH、Na2CO3溶液显碱性,NaOH是强碱,Na2CO3是强碱弱酸盐,CO32-水解造成溶液显碱性,即pH大小是c(NaOH)>c(Na2CO3),因此pH由大到小顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;(4)NH4Cl溶液中存在:NH4++H2O
HCO3-+OH-,造成溶液中c(OH-)>c(H+),溶液显碱性,即pH>7;(3)AlCl3、NH4HSO4溶液显酸性,AlCl3溶液显碱性是因为是Al3+水解造成,NH4HSO4溶液显酸性,发生NH4HSO4=NH4++H++SO42-,相同浓度时,NH4HSO4中c(H+)大于AlCl3溶液中c(H+),即pH大小顺序是c(NH4HSO4)<c(AlCl3),NaOH、Na2CO3溶液显碱性,NaOH是强碱,Na2CO3是强碱弱酸盐,CO32-水解造成溶液显碱性,即pH大小是c(NaOH)>c(Na2CO3),因此pH由大到小顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;(4)NH4Cl溶液中存在:NH4++H2O ![]() NH3·H2O+H+,NH4HSO4相当于在NH4Cl溶液中加入H+,抑制NH4+水解,因此NH4HSO4溶液中c(NH4+)大于NH4Cl溶液中c(NH4+);(5)NaOH和NH4HSO4混合,OH-先中和HSO4-中H+,当两者恰好完全反应,溶质为Na2SO4和(NH4)2SO4,溶液显酸性,根据题意,溶液为中性,因此继续滴加NaOH,发生NH4++OH=NH3·H2O,当pH=7时,溶质为Na2SO4、(NH4)2SO4、NH3·H2O,因此离子浓度大小顺序是:c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。
NH3·H2O+H+,NH4HSO4相当于在NH4Cl溶液中加入H+,抑制NH4+水解,因此NH4HSO4溶液中c(NH4+)大于NH4Cl溶液中c(NH4+);(5)NaOH和NH4HSO4混合,OH-先中和HSO4-中H+,当两者恰好完全反应,溶质为Na2SO4和(NH4)2SO4,溶液显酸性,根据题意,溶液为中性,因此继续滴加NaOH,发生NH4++OH=NH3·H2O,当pH=7时,溶质为Na2SO4、(NH4)2SO4、NH3·H2O,因此离子浓度大小顺序是:c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。