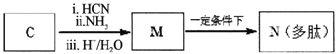
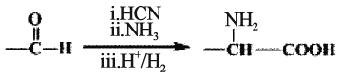题目内容
【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中碳元素的化合价+2价,N元素显-3价,则非金属性N__________C(填<,=或 >),用离子方程式表示NaCN溶液呈强碱性的原因:____________________。
(2)己知:
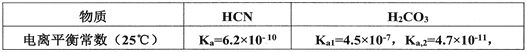
则向NaCN溶液通入少量CO2反应的离子方程式:____________________
(3)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
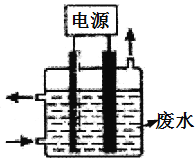
A.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
B.用石墨作阳极,铁作阴极
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________________;
(5)化合物(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与NaOH溶液反应的化学方程式:____________________。
【答案】 > CN-+H2O![]() HCN+OH- CN-+CO2+H2O=HCO3-+HCN A NaCN+H2O2+H2O=NaHCO3+NH3↑ (CN)2+2NaOH=NaCN+NaCNO+H2O
HCN+OH- CN-+CO2+H2O=HCO3-+HCN A NaCN+H2O2+H2O=NaHCO3+NH3↑ (CN)2+2NaOH=NaCN+NaCNO+H2O
【解析】(1)①CN-中C元素显+2价,N元素显-3价,说明N非金属性强;氰化钠为强碱弱酸盐,水解反应为:CN-+H2OHCN+OH-,溶液呈碱性,故答案为:>;CN-+H2OHCN+OH-;
②碳酸的一级电离常数大于HCN的,二级电离常数小于HCN的,故碳酸的酸性强于HCN,为碳酸氢根的酸性溶于HCN,故向NaCN溶液中通入少量CO2,反应生成HCN与NaHCO3,该反应离子方程式为:CN-+CO2+H2O=HCN+HCO3-,故答案为:CN-+CO2+H2O=HCN+HCO3-;
(3)A.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故A错误;B.根据装置图,该电解质溶液呈碱性,电解时,阳极要生成氯气,所以铁不能作阳极,石墨做阳极,铁做阴极,故B正确;C.电解质溶液呈碱性,则阴极电极反应式为2H++2e-=H2↑,故C正确;D.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故D正确;故选A;
(4)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(5)(CN)2和NaOH溶液反应可以类推氯气和氢氧化钠溶液的反应,所以反应的化学方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,故答案为:(CN)2+2NaOH=NaCN+NaCNO+H2O。