题目内容
【题目】下列说法错误的是( )
A. 0.3 molH2SO4 B. 1 molH2O C. 0.5 molNa D. 1.5 mol氧
【答案】D
【解析】
物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n,物质的量的单位为摩尔(mol),它可以计量所有微观粒子(包括原子、分子、离子、原子团、电子、质子、中子等),但必须指代明确。
物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n,物质的量的单位为摩尔(mol),它可以计量所有微观粒子(包括原子、分子、离子、原子团、电子、质子、中子等),但必须指代明确,1.5 mol氧中,说法指代不明,故D项错误;
答案选D。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】下列说法正确的是
A.3-戊醇和2-甲基-2-丁醇互为同系物
B.顺-2-丁烯和反-2-丁烯的加氢产物不同
C.CH2=C(CH3)2的名称是2-甲基-2-丙烯
D.沸点:1-丁醇>戊烷>2-甲基丁烷
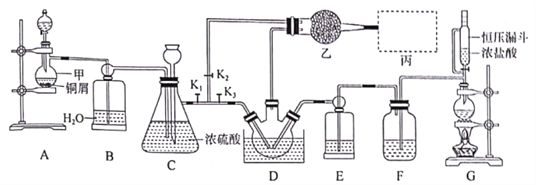
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。