题目内容
【题目】T℃时,某一气态平衡体系中含有x(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=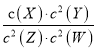 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A. 升高温度,W(g)体积分数增加,则正反应是放热反应
B. 减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C. 平衡正向移动,化学平衡常数一定增大
D. 该反应可表示为X(g)+2Y(g)![]() 2Z(g) + 2W(g)
2Z(g) + 2W(g)
【答案】A
【解析】从K的表达式可知Z、W是反应物,X、Y是生成物。A. W是反应物,升高温度,W(g)体积分数增加,则正反应是放热反应,故A正确;B. X是生成物,减小X浓度,平衡向正反应方向移动,平衡常数K不变,故B错误;C. 平衡正向移动,化学平衡常数不一定增大,若温度不变,则化学平衡常数不变,故C错误;D. Z、W是反应物,X、Y是生成物,该反应可表示为2Z(g) + 2W(g)![]() X(g)+2Y(g),故D错误。故选A。
X(g)+2Y(g),故D错误。故选A。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):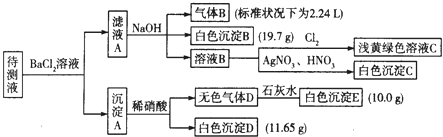
(1)写出生成白色沉淀B的离子方程式: .
(2)若无色气体D是单一气体: ①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 .
