题目内容
18.已知铜粉投入到硫酸铁溶液中有下列反应:2Fe3++Cu=Cu2++2Fe2+,则铁粉投入到硫酸铁溶液中的离子反应方程式为2Fe3++Fe=3Fe2+.分析 铁粉投入到硫酸铁溶液中反应生成硫酸亚铁,以此来解答.
解答 解:铁粉投入到硫酸铁溶液中反应生成硫酸亚铁,离子反应为2Fe3++Fe=3Fe2+,遵循电子、电荷守恒,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列各组物质中,均为纯净物的一组是( )
| A. | 碘酒、硫酸 | B. | 臭氧、石油 | C. | 氢气、冰水混合物 | D. | NaOH、天然气 |
10.维生素C能增强人体对疾病的抵抗能力,促进人体生长发育.下列物质富含维生素C的是( )
| A. | 牛肉 | B. | 辣椒 | C. | 鸡蛋 | D. | 淀粉 |
7.在两个容积不同的容器中,一个盛有HCl气体,另一个盛有H2和C12(黄绿色气体)的混合气体.在同温同压下,两容器内的气体可能具有相同的( )
| A. | 分子数 | B. | 颜色 | C. | 原子数 | D. | 密度 |

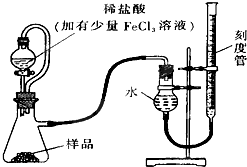 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•