题目内容
【题目】(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图示,然后回答问题:
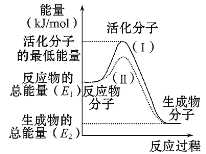
①图中所示反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=____ (用含E1、E2的代数式表示)。
②由上图可知曲线Ⅱ较曲线Ⅰ低,这是由于________。
(2)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)![]() CH3OH(g)ΔH1 ②CO2(g)+3H2(g)
CH3OH(g)ΔH1 ②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)
CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/ kJ·mol-1 | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1= _____kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=___kJ·mol-1。
【答案】放热 —(E1-E2)kJ/mol 或 (E2-E1)kJ/mol 加入催化剂 -99 +41
【解析】
(1)①由图可知,该反应反应物的总能量高于生成物的总能量,ΔH=生成物的总能量-反应物的总能量;
②加入催化剂可降低反应的活化能;
(2)根据ΔH=反应物的总键能-生成物的总键能计算ΔH1,根据盖斯定律进行计算。
(1)①由图可知,该反应反应物的总能量高于生成物的总能量,为放热反应,ΔH=生成物的总能量-反应物的总能量= (E2-E1)kJ/mol;
②由图可知曲线Ⅱ较曲线Ⅰ低,反应的活化能降低,因此是加入催化剂造成的;
(2)ΔH1=1076kJ/mol+2×436kJ/mol-3×413kJ/mol-343kJ/mol-465kJ/mol=-99 kJ·mol-1;
根据盖斯定律,②-①=③,则ΔH3=-58kJ/mol-(-99kJ/mol)=+41 kJ·mol-1。

 期末集结号系列答案
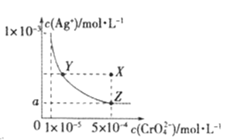
期末集结号系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。