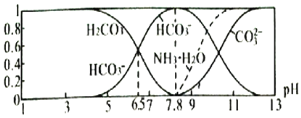
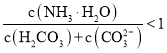题目内容
【题目】为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
【答案】放热 高 热能 低
【解析】
当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,说明反应中放出热量导致瓶内压强增大,据此解答。
(1)因为发生反应A+B=C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应;
(2)因为反应为放热反应,所以A和B的总能量比C和D的总能量高;
(3)化学变化伴随着物质和能量变化,物质中的化学能通过化学反应转化成热能释放出来;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为放热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。