��Ŀ����
����Ŀ����������ĵ���ƽ�ⳣ�������
���� | HCOOH | H2S | H2SO3 |
����ƽ�ⳣ�� (25��) | K��1.8��10��4 | K1��9.1��10��8 K2��1.1��10��12 | K1��1.23��10��2 K2��6.6��10��8 |
(1)���ʵ�����Ϊ0.1mol/L����Һ��HCOONa��NaHS��Na2SO3��pH������________(����)
(2)���ʵ��֤��HCOOHΪ����
(3)�����£�������Һ��ˮ�������c(H��)ˮ�ɴ�С��˳��Ϊ________(����)
��pH��12��NaOH��Һ ��NaCl��Һ ��pH��6��NH4Cl��Һ ��0.01mol/L����
(4)��Ԫ��H2A��ˮ�д������µ��룺H2A��H����HA����HA��![]() H����A2�����Իش��������⣺
H����A2�����Իش��������⣺
��NaHA��Һ�� (����ԡ��������ԡ��������ԡ� )
��ij�¶��£�10mL��0.1mol/LNaHA��Һ�м���0.1mol/LKOH��ҺVmL�����ԣ���ʱ��Һ�����¹�ϵһ����ȷ����( )
A����Һ��pH��7 B��Kw��c2(OH��) C��V��10 D��c(K��)�� c(Na��)
(5)��ͼ������Ϊ��������Һ��pH��������Ϊ�����������ʵ���Ũ�ȵĶ���(����Һ�н�������Ũ�ȡ�10��5mol/Lʱ������Ϊ������ȫ)���Իش�
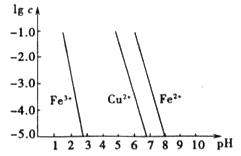
��ʴͭ�����Һ�У���Cu2����Fe3����Fe2��Ũ�Ⱦ�Ϊ0.1mol/L��������Һ��ͨ�백��������Һ��pH��5.6ʱ����Һ�д��ڵĽ���������Ϊ ��
��ͼ�е����ݼ���ɵ�Fe(OH)2�ܶȻ�Ksp[Fe(OH)2]�� ��
���𰸡�(1)��(2)(2��)����ʱ���ⶨ0.1mol/L HCOOH��Һ��pH��1������ʱ���ⶨHCOONa��Һ��pH��7��(���������Ĵ�Ҳ��)
(3)�������������� (4)���ԣ� BD (5)Cu2����Fe2�� 10��17��1��10��17
��������
���������(1)�ɵ���ƽ�ⳣ����֪���ԣ�H2SO3��HCOOH��HSO3-��H2S��HS-������Խ������ͬ�����µ�Ũ�ȵ�ǿ������Һ��pHԽ������HCOONa��NaHS��Na2SO3��pH����������
(2)�ɸ���HCOOH������ȫ�����HCOO-����ˮ����֤��HCOOHΪ���������巽��Ϊ����ʱ���ⶨ0.1mol/L HCOOH��Һ��pH��1������ʱ���ⶨHCOONa��Һ��pH��7��
(3)��pH��12��NaOH��Һ����ˮ�ĵ��룻 ��NaCl��Һ��ˮ�ĵ���û��Ӱ�죻 ��pH��6��NH4Cl��Һ��NH4+��ˮ��ٽ�ˮ�ĵ��룻 ��0.01mol/L������Һ����ˮ�ĵ��룬�����������ᣬ��ˮ�ĵ���������������ͬŨ�ȵ�NaOH��Һ����������Һ��ˮ�������c(H��)ˮ�ɴ�С��˳��Ϊ����������������
(4)����HA-![]() H++A2-��֪��Na2AΪǿ�������Σ�NaHAΪ��ʽ�Σ�H2A��һ����ȫ���룬����HA-ֻ���룬������ˮ�⣬HA-�������������ӣ�������Һ�����ԣ�
H++A2-��֪��Na2AΪǿ�������Σ�NaHAΪ��ʽ�Σ�H2A��һ����ȫ���룬����HA-ֻ���룬������ˮ�⣬HA-�������������ӣ�������Һ�����ԣ�
��A�������¶Ȳ�֪����������ʱ��ҺpH����ȷ������A����B������c(OH-)=c(H+)��Kw=c(OH-)c(H+)=KW=c2(OH-)����B��ȷ��C��HA-�� OH-ǡ�÷�Ӧʱ����A2-����Һ�ʼ��ԣ���֪��ҺΪ���ԣ�˵��NaHA��Һ��ʣ�࣬��V��10����C����D������Cѡ���жϣ�NaHA����������c(K+)��c(Na+)����D��ȷ���ʴ�ΪBD��
(5)��������Һ��ͨ�백��������Һ��pH=5.6ʱ����ͼ���֪������Fe(OH)3��������Һ�д��ڵĽ���������ΪCu2+��Fe2+��
����ͼ���֪��c(Fe2+)=1.0��10-5(molL-1)��c(OH-)=1.0��10-6(molL-1)��Ksp[Fe(OH)2]=c(Fe2+)��c2(OH-)=1.0��10-17(molL-1)3��


