题目内容
【题目】人体吸入CO后在肺中发生反应![]() 导致人体缺氧。向某血样中通 入CO与O2的混合气
导致人体缺氧。向某血样中通 入CO与O2的混合气![]() ,氧合血红蛋白 HbO2浓度随时间变化曲线如下图所示。下列说法正确的是
,氧合血红蛋白 HbO2浓度随时间变化曲线如下图所示。下列说法正确的是

A. 反应开始至4s内用HbO2表示的平均反应速率为![]()
B. 反应达平衡之前,O2与HbCO的反应速率逐渐减小
C. 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理
D. 该温度下反应![]() 的平衡常数为107
的平衡常数为107
【答案】C
【解析】A、反应开始至4s内用HbO2表示的平均反应速率为(1.0×10-4mol/L-0.2×10-4mol/L)/4S=2×10―5mol/(L·S),故A错误;B、反应达平衡之前,O2与HbCO的反应速率逐渐增大,直到平衡,故B错误;C、将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理:增大氧气的浓度,使平衡逆向移动,使HbO 2 浓度增大,HbCO浓度减小,故C正确;D、根据平衡常数K=c(O2)c(HbCO)/c(CO)c(HbO2)= (10.7×10-4 × 0.8×10-4) / (0.2×10-4 × 0.2×10-4)=214,故D错误。

【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
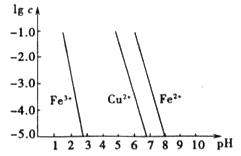
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。