题目内容
【题目】某有机物分子式为C4H8,据此推测其结构和性质不可能的是 ( )
A.它与乙烯可能是同系物
B.一氯代物可能只有一种
C.分子结构中甲基的数目可能是0、1、2
D.等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
【答案】D
【解析】
试题分析:A.某有机物分子式为C4H8,H原子是C原子2倍,则该有机物可能是单烯烃或环丁烷,如果是烯烃,则与乙烯是同系物,故A正确;B.如果是环丁烷,只有一种氢原子,氢原子种类决定其一氯代物种类,所以如果是环丁烷,其一氯代物只有一种,故B正确;C.该物质可能是环丁烷(无甲基)、1-甲基环丙烷(一个甲基)、1-丁烯(一个甲基)或2-丁烯(2个甲基),所以分子结构中甲基的数目可能是0、1、2,故C正确;D.设烃的化学式为CxHy,等质量的烃耗氧量=![]() ,根据式子知,如果y/x越大相同质量时耗氧量就越多,所以等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量大于C4H8,故D错误;故选D。
,根据式子知,如果y/x越大相同质量时耗氧量就越多,所以等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量大于C4H8,故D错误;故选D。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
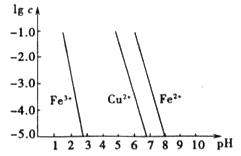
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
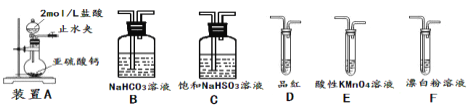
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A![]() ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
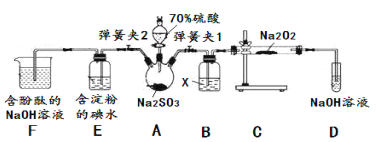
操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |